
| A. | 海水晒盐 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨溶于水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
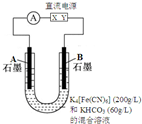 气态废弃物中的硫化氢可用下法转化为可利用的硫.
气态废弃物中的硫化氢可用下法转化为可利用的硫.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
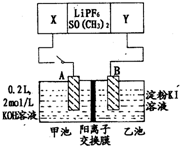 已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )
已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )| A. | 从隔膜中通过的离子数目为0.4 NA | |
| B. | 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol/L | |
| C. | A电极为阳极 | |
| D. | 电源正极反应式为:FeS+2Li++2e-═Fe+Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿矿井时用火把照明 | |
| B. | 实验室在通风橱中制备氯气 | |
| C. | 将水倒入浓硫酸配制稀硫酸 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有Fe3+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Fe3+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c (Al3+)=1.00 mol•L-1 | |
| D. | c(Na+)=0.50 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的A1Cl3溶液中:Na+、K+、CO32-、NO3- | |
| B. | pH=13的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(OH-)=1×10-13mol•L-1的溶液中:Mg2+、K+、Cl-、SO42- | |
| D. | 无色透明溶液中:Ca2-、NH4+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com