
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: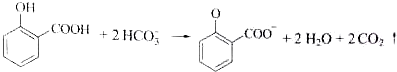 | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
分析 A.铵根离子水解生成一水合氨和氢离子,为可逆反应;
B.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应;
D.草酸为弱酸,是弱电解质,弱电解质应保留化学式.
解答 解:A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱,l离子方程式:NH4++2H2O?NH3•H2O+H3O+,故A错误;
B.用氢氧化钠溶液除去镁粉中的杂质铝:,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故B正确;
C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应,离子方程式为 +HCO3-→
+HCO3-→ +H2O+CO2↑,故C错误;
+H2O+CO2↑,故C错误;
D.弱电解质写化学式,离子方程式为2MnO4-+6H++5H2C2O4═2Mn2++10CO2↑+8H2O,故D错误;
故选:B.
点评 本题考查离子方程式的书写,为高频考点,明确物质之间反应、物质性质及离子方程式书写规则是解本题关键,涉及盐类水解、氧化还原反应等知识点,注意酚羟基和羧基活泼性,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变 | |
| B. | 加入少量固体CuSO4,c (H+)增大,Kw不变 | |
| C. | 加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| D. | 加热到90℃,Kw增大,溶液仍呈中性,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) | |
| B. | x=20时溶液导电能力比x=15时溶液导电能力强 | |
| C. | x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) | |
| D. | x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中阳离子总数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鼓励使用液化石油气做燃料 | B. | 鼓励使用太阳能、风能等能源 | ||
| C. | 鼓励煤火力发电,少用水力发电 | D. | 鼓励用私家车,少坐公交车出行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com