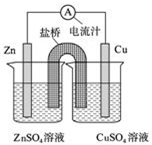
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.室温时某溶液的pH<7,该物质可能是强酸强碱酸式盐;
B.电离平衡常数=
=1×10
-7,则c(H
+)=
=10
-4mol/L,电离度=
×100%;
C.混合溶液中的溶质为等物质的量浓度的CH
3COOH和CH
3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变.
解答:
解:A.室温时某溶液的pH<7,该物质可能是强酸强碱酸式盐,如NaHSO
4溶液,故A错误;
B.电离平衡常数=
=1×10
-7,则c(H
+)=
=10
-4mol/L,电离度=
×100%=
×100%=0.1%,故B错误;
C.混合溶液中的溶质为等物质的量浓度的CH
3COOH和CH
3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(H
+)+c(Na
+)=c(OH
-)+c(CH
3COO
-),根据物料守恒得c(CH
3COOH)+c(CH
3COO
-)=2c(Na
+),所以得2c(H
+)+c(CH
3COOH)=2c(OH
-)+c(CH
3COO
-),故C正确;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变,向CaSO
4饱和溶液中加入Na
2SO
4溶液,CaSO
4不一定析出,故D错误;
故选C.
点评:本题考查了弱电解质的电离、酸碱混合溶液大小判断、难溶物的溶解平衡等知识点,根据弱电解质的电离及电离度公式、盐的性质、溶度积常数与温度的关系等知识点来分析解答,易错选项是D,注意加入硫酸钠溶液和硫酸钠固体的区别,为易错点.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案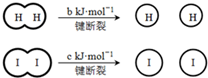 H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )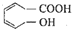 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )