
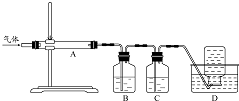
 氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:分析 (1)木炭还原硫酸镁煅烧制备高纯氧化镁,由图可知,在A中发生煅烧反应,生成气体含CO2、SO2、CO,B中高锰酸钾吸收SO2,C中NaOH溶液吸收CO2,最后D中收集不溶于水的气体CO;
(2)CO2与Na2O2反应生成碳酸钠和氧气;
(3)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水;
(4)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,则生成亚硫酸钠、硫化钠和水.
解答 解:(1)木炭还原硫酸镁煅烧制备高纯氧化镁,由图可知,在A中发生煅烧反应,生成气体含CO2、SO2、CO,二氧化碳、二氧化硫均与NaOH、Na2CO3溶液反应,均与硝酸不反应,只有二氧化硫与高锰酸钾反应,则B中高锰酸钾吸收SO2,C中NaOH溶液吸收CO2,最后D中收集不溶于水的气体CO,
故答案为:CO;d;
(2)CO2与Na2O2反应生成碳酸钠和氧气,反应为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,则生成亚硫酸钠、硫化钠和水,离子反应为3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O,
故答案为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O.
点评 本题以物质制备实验考查物质的性质,为高频考点,把握实验装置的作用、气体的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| C. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1mol•L-1pH为4的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 0.1 mol•L-1 Na2S溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com