
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应(双氧水分解是放热反应)、个别的化合反应(如C和CO2)、置换以及某些复分解反应(如铵盐和强碱),以此解答该题.
解答 解:②将胆矾加热变为白色粉末、④KClO3分解制取O2、⑥CaCO3高温分解等属于分解反应,为吸热反应,而⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO、⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2 等属于以C、氢气为还原剂的吸热反应;⑧Ba(OH)2•8H2O与固体NH4Cl混合,为吸热反应;
①液态水汽化、③浓硫酸稀释为物理变化,不是吸热反应,也不是放热反应;
⑤生石灰与水反应生成熟石灰、⑩Al与盐酸反应为放热反应.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
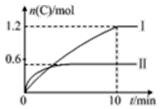 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 上述方程式中a=-160 | |
| B. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
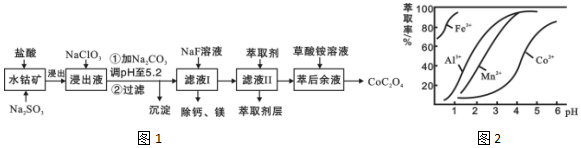
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
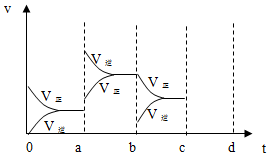
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com