
| A. | 该反应的还原剂只有FeSO4 | |
| B. | 每生成1mol Na2FeO4只转移5mol的电子 | |
| C. | K2FeO4作为水处理剂时仅起杀菌消毒的作用 | |
| D. | 该反应在水溶液中进行并不影响高铁酸钾的生产 |
分析 2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2,FeSO4中Fe由+2价升高到+6价,Na2O2中O由-1价部分升高到0价部分降低到-2价,所以
该反应的还原剂为FeSO4和Na2O2,氧化剂为Na2O2,
A、根据以上分析,该反应的还原剂为FeSO4和Na2O2;
B、根据化合价的变化计算转移的电子数目;
C、根据K2FeO4具有强氧化性,被还原为Fe3+,水解生成Fe(OH)3;
D、根据K2FeO4具有强氧化性,水溶液中含有还原性离子,会发生氧化还原反应分析.
解答 解:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2,FeSO4中Fe由+2价升高到+6价,Na2O2中O由-1价部分升高到0价部分降低到-2价,所以该反应的还原剂为FeSO4和Na2O2,氧化剂为Na2O2,
A、根据以上分析,该反应的还原剂为FeSO4和Na2O2,故A错误;
B、每生成1molNa2FeO4,有1molFeSO4参加反应,化合价由+2价升高到+6价,还生成0.5mol氧气,由Na2O2中的氧由-1价升高到0价的O2,所以转移电子为4+1=5mol,故B正确;
C、K2FeO4具有强氧化性,可用于消毒杀菌,被还原为Fe3+,水解生成Fe(OH)3,具有吸附性,可用于吸附水中的悬浮杂质,故C错误;
D、因为K2FeO4具有强氧化性,水溶液中含有还原性离子,所以该反应在水溶液中进行就会发生氧化还原反应,从而得不到高铁酸钾,故D错误;
故选B.
点评 本题考查氧化还原反应,题目难度中等,从化合价变化的角度分析氧化还原反应,把握氧化剂的应用.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③ | B. | 仅②③ | C. | 仅①② | D. | 仅③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 由c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- | |
| D. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Mg2+、Cu2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉、麻、蚕丝灼烧时只有无色无味的物质生成 | |
| B. | 酒精、汽油的危险品标志是 | |
| C. | 坚持饮用纯水,有利于人体健康 | |
| D. | 含氮量很髙的氨气,可直接作为农作物的优质氮肥施用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发皿 | B. | 漏斗 | C. | 蒸馏烧瓶 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙、铁、锌、硒都是人体必需的微量元素 | |
| B. | 发现煤气泄漏应立即关闭阀门,开窗通风 | |
| C. | 用肥皂水可鉴别硬水和软水 | |
| D. | 氢能源的大量应用需解决制取成本高、贮存困难等问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
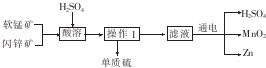
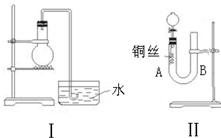 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果.根据要求回答下列问题:
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果.根据要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com