
【题目】下列叙述不正确的是( )
A.与28 gCO具有相同分子数的C2H4的质量一定是28 g
B.1 molAl 3+含有的核外电子数为3NA
C.常温常压下,1 mol甲烷含有的原子数为5NA
D.常温常压下,1 molL氢气的体积大于22.4 L
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识并结合如图所示的装置回答下列问题.
(1)图中标有①、②的仪器名称:①;② .
(2)用装置B制取一种气体的化学方程式为;该气体收集方法可选用图中 . (填图中标号)
(3)用高锰酸钾制取氧气的化学方程式为 . 若选择A和C装置制取并收集氧气,则要对A装置进行的改进是 . 证明氧气已收集满的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由葡萄糖发酵可得乳酸,为研究乳酸的分子组成和结构,进行了下述实验:
(1)称取乳酸0.90g,在某种状况下使其完全气化,相同状况下同体积的H2的质量为0.02g,则乳酸的相对分子质量为 .
(2)若将上述乳酸蒸气在氧气中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰的质量增加1.86g;若将此产物通入过量石灰水中,则产生3.00g白色沉淀.则乳酸的分子式为 .
(3)另取0.90g乳酸,若与足量金属钠反应,生成H2224mL(标准状况),若与足量碳酸氢钠反应,生成224mLCO2(标准状况),则乳酸的结构简式可能为或 .
(4)若葡萄糖发酵只生成乳酸,其反应的化学方程式为 .
(5)乳酸与乙酸、乳酸与乙醇均能发生酯化反应,相同质量乳酸所生成的两种酯化产物(有机物)的质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2mol C B. 2mol A、3mol B和1mol He(He不参加反应)
C. 1mol B和1mol C D. 2mol A、3mol B和3mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”是用饭店的泔水及垃圾猪肉等加工而成的“食用油”。下列有关说法中正确的是( )
A. “地沟油”的主要成分是蛋白质,还含有较多的微量元素
B. “地沟油”外观与普通食用油一样,经过处理的“地沟油”具有固定的熔沸点
C. “地沟油”在加入消泡剂后,消除了其对人体健康的影响
D. “地沟油”可用于生产生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】引起下列环境污染的原因不正确的是
A. 重金属、农药和难分解的有机物会造成水体污染
B. 装饰材料中的甲醛会造成居室污染
C. SO2、NO2、CO2都会导致酸雨的形成
D. CO2和CH4的大量排放会造成温室效应的加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
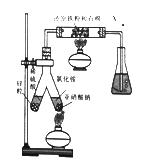
①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
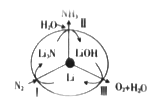
①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是

A. X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐
B. 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
C. Z的单质常温下是液体,可与铁粉反应
D. Z的原子序数比Y大9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)一定条件下的密闭容器中,进行反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
A.NO的生成速率与NO的消耗速率相等 B.υ(CO)=υ(CO2)
C.体系的压强保持不变 D.各物质的浓度保持不变
(2)可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:C(s)+2NO(g)![]() N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L﹣1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
①写出该反应的平衡常数表达式:K=____________________。
②30min后,改变某一条件,平衡发生了移动,则改变的条件是_______________;若升高温度,NO浓度将_______(填“增大”、“不变”或“减小”)。
③计算从0~20min内,NO的平均反应速率为___________________。
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com