
(20分)以配制250 mL 1mol /L氢氧化钠溶液为例。实验步骤
①计算:需要NaOH固体质量。
②称量:用托盘天平称取___________gNaOH固体,称量时要注意两个问题:一要装在________里称,二要迅速。
③溶解:用量筒量取蒸馏水注入烧杯里,用玻璃棒搅拌。
④冷却:将溶液冷却至室温。
⑤移液:将冷却溶液用_____ 引流到____________ 中。在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
⑥洗涤:用适量蒸馏水洗涤烧杯和玻璃棒_____ 次,并将洗涤液注入容量瓶里。
⑦振荡:手持容量瓶轻轻振荡,使溶液充分混合均匀。
⑧定容:继续加蒸馏水至距刻度线_____ 处,然后,改用____ _ 滴加蒸馏水正好至刻度线。若加水超过刻度线,会造成溶液浓度偏 (高或低),应该 。
⑨摇匀:盖好玻璃塞,反复上下颠倒,使溶液均匀。
10.0;小烧杯;玻璃棒;250mL容量瓶;偏低; 2-3次;1-2cm ;胶头滴管 ;低;重新配制
【解析】考查一定物质的量浓度溶液的配制。
250 mL 1mol /L氢氧化钠溶液中溶质的物质的量是0.25mol×1mol/L=0.25mol,其质量是0.25mol×40g/mol=10.0g;氢氧化钠易吸水,所以称量时应该放在小烧杯中称量;将溶液转移至容量瓶中需要玻璃棒引流;如果溶液损失,则溶质就减少,因此浓度就偏低;烧杯和玻璃棒都需要洗涤2~3次,关键时洗涤液要注入容量瓶中;当液面接近刻度线1~2cm时,应该用胶头滴管定容;如果加水超过刻度线,则溶液体积偏大,浓度就偏低,此时只能是重新配制。


科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸;②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7 g氯化钠晶体;④用碱式滴定管量取23.10 mL溴水;⑤用瓷坩埚灼烧各种钠的化合物;⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液。
A.. ①②④ B.②③④⑥ C.. ③⑥ D.. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
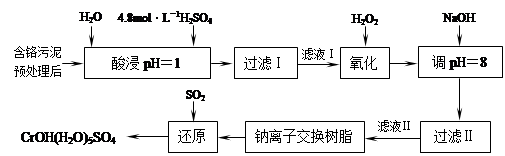
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省连州市连州中学高一10月月考化学试卷(带解析) 题型:实验题
(20分)以配制250 mL 1mol /L氢氧化钠溶液为例。实验步骤
①计算:需要NaOH固体质量。
②称量:用托盘天平称取___________gNaOH固体,称量时要注意两个问题:一要装在________里称,二要迅速。
③溶解:用量筒量取蒸馏水注入烧杯里,用玻璃棒搅拌。
④冷却:将溶液冷却至室温。
⑤移液:将冷却溶液用_____ 引流到____________ 中。在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
⑥洗涤:用适量蒸馏水洗涤烧杯和玻璃棒_____ 次,并将洗涤液注入容量瓶里。
⑦振荡:手持容量瓶轻轻振荡,使溶液充分混合均匀。
⑧定容:继续加蒸馏水至距刻度线_____ 处,然后,改用____ _ 滴加蒸馏水正好至刻度线。若加水超过刻度线,会造成溶液浓度偏 (高或低),应该 。
⑨摇匀:盖好玻璃塞,反复上下颠倒,使溶液均匀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com