
【题目】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为 , 若只改变一个影响因素,当平衡移动时,K值变化(填“一定”或“不一定”);当K值变大时,逆反应速率 . (填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是 . a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为 .
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是 .
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是 , 请结合离子方程式,运用平衡原理进行解释: .
【答案】
(1)![]() ;不一定;增大
;不一定;增大
(2)cd
(3)0.0018 mol/(L?min)
(4)H2SO4 HCl
(5)白色沉淀生成,溶液红色褪去;亚硫酸钠溶液水解成碱性,滴入酚酞成红色.SO32﹣+H2O?HSO3﹣+OH﹣ , 加入氯化钡后,Ba2++SO32﹣→BaSO3↓,降低了SO32﹣的浓度,使得水解平衡往左移动,导致溶液中OH﹣浓度降低,因此溶液红色褪去
【解析】解:(1)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),反应的平衡常数表达式K= ![]() ,影响化学平衡的因素有温度、压强、浓度等,改变一个条件平衡发生移动,但平衡常数只随温度变化,不随压强、浓度的改变,所以若只改变一个影响因素,当平衡移动时,K值不一定变化,反应是吸热反应,当K值变大时,说明是温度影响,平衡正向进行,说明是升温平衡正向进行,正逆反应速率都增大, 故答案为:
,影响化学平衡的因素有温度、压强、浓度等,改变一个条件平衡发生移动,但平衡常数只随温度变化,不随压强、浓度的改变,所以若只改变一个影响因素,当平衡移动时,K值不一定变化,反应是吸热反应,当K值变大时,说明是温度影响,平衡正向进行,说明是升温平衡正向进行,正逆反应速率都增大, 故答案为: ![]() ;不一定;增大;(2)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),反应是气体体积不变的吸热反应,a.反应前后气体体积不变,反应过程中容器内压强始终保持不变,反应达到平衡状态,压强不变,故a正确;b.反应达到平衡状态,物质的量不变,氢气和水蒸汽的物质的量之比保持不变,故B正确;c.固体不影响化学平衡,加入少量Fe3O4固体和水蒸气反应,平衡正向移动,故c错误;d.固体不影响化学平衡,移除部分Na2S固体,平衡不发生移动,故d错误;故答案为:cd;(3)设反应消耗的氢气为nmol,
;不一定;增大;(2)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),反应是气体体积不变的吸热反应,a.反应前后气体体积不变,反应过程中容器内压强始终保持不变,反应达到平衡状态,压强不变,故a正确;b.反应达到平衡状态,物质的量不变,氢气和水蒸汽的物质的量之比保持不变,故B正确;c.固体不影响化学平衡,加入少量Fe3O4固体和水蒸气反应,平衡正向移动,故c错误;d.固体不影响化学平衡,移除部分Na2S固体,平衡不发生移动,故d错误;故答案为:cd;(3)设反应消耗的氢气为nmol,
Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)△m
4mol 64 g
n (2.84﹣2.264)g
解得n=0.036mol,则该时间范围内的平均反应速率v(H2)= ![]() ═0.0018mol/(L.min),
═0.0018mol/(L.min),
故答案为:0.0018 mol/(Lmin);(4)往Ba(C1O)2溶液中通入足量SO2气体发生Ba(C1O)2+2SO2+2H2O=BaSO4↓+H2SO4+2HCl,则反应后溶液的溶质为H2SO4、HCl,故答案为:H2SO4 , HCl;(5)亚硫酸钠是强碱弱酸盐,亚硫酸钠水解而使溶液呈碱性,SO32﹣+H2OHSO3﹣+OH﹣ , 滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,Ba2++SO32﹣═BaSO3↓(白色),由于SO32﹣浓度减小,水解平衡左移,OH﹣浓度减小,溶液褪色,故答案为:白色沉淀生成,溶液红色褪去;亚硫酸钠溶液水解成碱性,滴入酚酞成红色.SO32﹣+H2OHSO3﹣+OH﹣ , 加入氯化钡后,Ba2++SO32﹣→BaSO3↓,降低了SO32﹣的浓度,使得水解平衡往左移动,导致溶液中OH﹣浓度降低,因此溶液红色褪去.
(1)反应的平衡常数= ![]() ,固体和纯液体不写入表达式,平衡常数只随温度变化;反应是吸热反应,升温促进平衡正向进行,平衡常数增大;(2)反应是气体体积不变的吸热反应,反应达到平衡状态,正逆反应速率相同时,各组分含量保持不变,变量不变说明反应达到平衡状态;(3)根据方程式计算反应的氢气的物质的量,再求出反应速率;(4)二氧化硫水溶液呈酸性,C1O﹣在酸性条件下具有强氧化性,可与二氧化硫发生氧化还原反应,以此解答该题;(5)亚硫酸钠是强碱弱酸盐,亚硫酸钠水解而使溶液呈碱性,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,由于SO32﹣浓度减小,水解平衡左移,OH﹣浓度减小,溶液褪色,据此即可解答.
,固体和纯液体不写入表达式,平衡常数只随温度变化;反应是吸热反应,升温促进平衡正向进行,平衡常数增大;(2)反应是气体体积不变的吸热反应,反应达到平衡状态,正逆反应速率相同时,各组分含量保持不变,变量不变说明反应达到平衡状态;(3)根据方程式计算反应的氢气的物质的量,再求出反应速率;(4)二氧化硫水溶液呈酸性,C1O﹣在酸性条件下具有强氧化性,可与二氧化硫发生氧化还原反应,以此解答该题;(5)亚硫酸钠是强碱弱酸盐,亚硫酸钠水解而使溶液呈碱性,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,由于SO32﹣浓度减小,水解平衡左移,OH﹣浓度减小,溶液褪色,据此即可解答.


科目:高中化学 来源: 题型:
【题目】某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z,它们的物质的量随时间的变化如图所示,则下列说法正确的是(注:转化率=某反应物变化的浓度除它的起始浓度)

A. 反应的化学方程式是 X+2Y = 2Z
B. 该反应达到平衡时反应物 X 的转化率α等于 55%
C. 该反应在 0-3min 时间内产物 Z 的平均反应速率 0.083mol·L-1·min-1
D. 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
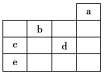
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7~8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是( )
A.常压蒸馏
B.减压蒸馏
C.加生石灰常压蒸馏
D.加压蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关 ![]() 分子结构的下列叙述中正确的是( )
分子结构的下列叙述中正确的是( )
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种食用香料,主要用于奶油、酸奶的加工.它也可用于有机合成,以A为原料制备阴离子树脂M和新型高分子材料N的合成路线如下: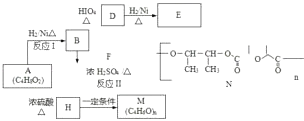
已知: ![]()
(1)写出反应类型:反应I;反应II .
(2)A中官能团的名称是;A属于酯类的同分异构体有种,其中只含一个甲基的同分异构的结构简式是: .
(3)D与新制Cu(OH)2反应的化学方程式是 .
(4)M的结构简式为 .
(5)某有机物CxHyOz(0<z<5)与A以任意比混合后燃烧,每摩尔混合物消耗5摩尔氧气.请写出该有机物可能的分子式 . (写两种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合气体由N2和CH4组成,测得混合气体在标准状况下的密度是0.821g/L,则混合气体中N2和CH4的体积之比为( )
A. 5∶1 B. 4∶1 C. 1∶4 D. 1∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com