
����Ŀ��Ŀǰ������ʹ����㷺�Ľ���֮һ����֪�ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ����ͼװ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱�� 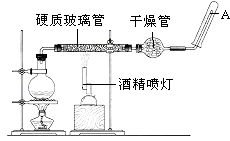
��ش����е����⣮
��1���������ڱ��е�λ���� ��
��2����д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3���������������������ﷴӦԭ�������Ӹֹ죬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4���������Ͳ���ɵĺϽ�a mol������Pt�����ʵ�������Ϊx���гɷ�ĩ״��ȫ��Ͷ�뺬b mol HNO3��ϡ��Һ�У�ʹ���ַ�Ӧ����HNO3�Ļ�ԭ����ֻ��NO���Իش��������⣺ ����HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д�±��հף�
�� | �� | �� | �� | |
��Һ�еĽ������� | Fe2+ | |||
��������ɷ� | Fe��Pt | Pt | Pt |
�ڵ�x=0.5������Һ��Fe3+��Fe2+�����ʵ�����ȣ��ڱ�״���¹�����112mL NO����a= �� b= ��
���𰸡�
��1����������,�ڢ���
��2��3Fe+4H2O��g�� ![]() Fe3O4+4H2��
Fe3O4+4H2��
��3��2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
��4��Fe2+�� Fe2+Fe3+�� Fe3+�� Fe2+��0.012��0.02
���������⣺��1��Fe��ԭ������Ϊ26��ԭ�ӽṹ����4�����Ӳ㣬����������Ϊ2����λ��Ԫ�����ڱ��е������ڣ��ڢ��壬���Դ��ǣ��������ڣ��ڢ��壻��2��Fe��ˮ������Ӧ������������������������ӦΪ3Fe+4H2O��g�� ![]() Fe3O4+4H2�������Դ��ǣ�3Fe+4H2O��g��
Fe3O4+4H2�������Դ��ǣ�3Fe+4H2O��g�� ![]() Fe3O4+4H2������3���������������ﷴӦ������������Fe����ӦΪ2Al+Fe2O3
Fe3O4+4H2������3���������������ﷴӦ������������Fe����ӦΪ2Al+Fe2O3 ![]() Al2O3+2Fe�����Դ��ǣ�2Al+Fe2O3
Al2O3+2Fe�����Դ��ǣ�2Al+Fe2O3 ![]() Al2O3+2Fe����4������HNO3���������ӣ�����㣬����3Fe+8HNO3=3Fe��NO3��2+2NO��+4H2O����������ΪFe2+����������ɷ�ΪFe��Pt��
Al2O3+2Fe����4������HNO3���������ӣ�����㣬����3Fe+8HNO3=3Fe��NO3��2+2NO��+4H2O����������ΪFe2+����������ɷ�ΪFe��Pt��
��������Feǡ�÷���3Fe+8HNO3=3Fe��NO3��2+2NO��+4H2O����������ΪFe2+����������ɷ�ΪPt��
��������Ӧ�����ϣ��ټ����ᣬ����3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����������ΪFe2+ Fe3+����������ɷ�ΪPt��
����������ǡ�ñ�����������3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����������ΪFe3+����������ɷ�ΪPt��
���Դ��ǣ�
�� | �� | �� | �� | |
��Һ�еĽ������� | Fe2+ | Fe2+ | Fe2+ Fe3+ | Fe3+ |
��������ɷ� | Fe��Pt | Pt | Pt | Pt |
��x=0.5������Һ��Fe3+��Fe2+�����ʵ�����ȣ������ʵ�����Ϊ0.25amol���ɵ����غ��֪��0.25a��2+0.25a��3= ![]() ����5��2�������a=0.012��
����5��2�������a=0.012��
��Nԭ���غ��֪b=0.25��0.012mol��2+0.25��0.012mol��3+ ![]() =0.02��
=0.02��
���Դ��ǣ�0.012��0.02��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ʺ���C��H��O��N��Ԫ�ء����й�����Ȼ���е�ѭ����˵���������
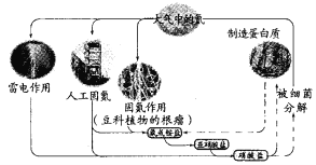
A. ��������ͺ����л�����ת��
B. ̼���⡢������Ԫ��Ҳ���ܲ����˵�ѭ��
C. ���ת��Ϊ�����Σ������˻�ԭ��Ӧ
D. Ŀǰ�˹��̵��ķ�ӦΪN2+3H2![]() 2NH3
2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ϡ���ᷴӦ��Ϊ�˼ӿ췴Ӧ���ʣ������ֲ�Ӱ�����ɵ��������������Բ�ȡ�Ĵ�ʩ�ǣ� ��
A.�����¶�
B.����������ˮ
C.��������CuSO4��Һ
D.����Ũ�Ƚϴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��д�����еķ���ʽ��
��1������������ˮ��Ӧ�Ļ�ѧ����ʽ��________��
��2����������Һ�백ˮ��Ӧ�����ӷ���ʽ��________��
��3����������ˮ������Ӧ�Ļ�ѧ����ʽ��________��
��4����������������ᷴӦ�Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CH2=CH2+O2 ![]() 2CH3CHO�������з�Ӧ�У������л���Ӧ����ķ�Ӧ��������ϩ��ͬ���ǣ� �� ����ȩת��Ϊ�Ҵ��ڱ������ڿ����б�����ȩ��������Ӧ��CH3CH2Br��NaOH����Һ�м��Ȣݱ�ͪ��CH3COCH3������������2������ �ױ�ʹ���Ը��������Һ��ɫ��������������������ˮ�⣮
2CH3CHO�������з�Ӧ�У������л���Ӧ����ķ�Ӧ��������ϩ��ͬ���ǣ� �� ����ȩת��Ϊ�Ҵ��ڱ������ڿ����б�����ȩ��������Ӧ��CH3CH2Br��NaOH����Һ�м��Ȣݱ�ͪ��CH3COCH3������������2������ �ױ�ʹ���Ը��������Һ��ɫ��������������������ˮ�⣮
A.�٢�
B.�٢ڢ�
C.�ڢۢ�
D.���ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������һ�����ʵ���Ũ����Һ�Ĺ���ʾ��ͼ������˵���������

A. �����Ƶ�Na2CO3,��Һ�����ʵ���Ũ��Ϊ1.0mol/L
B. ����2�ǽ��ܽ��Na2CO3,��Һת�Ƶ�����ƿ��
C. ����5�У�����ҡ�Ⱥ���Һ����ڿ̶��ߣ�Ҫ������ˮ��Һ����̶���ƽ��
D. ����4������ӣ���������ҺŨ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��һ��ɫ�����ĩ�����ܺ���NaCl��Na2SO4��Na2CO3��KNO3��BaCl2��CuSO4�е�һ�ֻ��֣������²������ʵ��:
�ٽ��ù����ĩ��������ˮ�еõ���ɫ��Һ�Ͱ�ɫ�����
�ڹ���,�ڲ������м�������ϡ���ᣬ�����ݲ�������ַ�Ӧ�����в�������ڡ�
��ȡ�ڵ���Һ���Թ���.����Cu�ۣ��ȣ�һ��ʱ����Թܿڳ��ֺ���ɫ��
��������ʵ�������ж�:
(1)�������һ��û��____��������_______��(���ѧʽ)
(2)д�����з�Ӧ�Ļ�ѧ����ʽ: _____________
(3)д��������Һ�ﷴӦ�����ӷ���ʽ:__________
��.A��B��C��X����ѧ��ѧ�г��������ʣ�����֮���ת����ϵ��ͼ��ʾ(���ֲ�������ȥ)����ش���������:
![]()
(1)��X��ǿ�����Ե��ʣ���A��������_________(�����)��
a.C b.N2 c.S d.Mg e.Al
(2)��A��ʹʪ��ļtɫʯ����ֽ������CΪ����ɫ�����塣Aת��ΪB�Ļ�ѧ����ʽΪ________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4 �� B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ�� 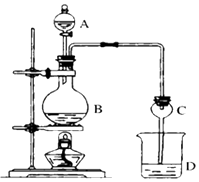
��֪������ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl26C2H5OH��
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
��ش�
��1��Ũ���������������ͬλ��18Oʾ�ٷ�ȷ����Ӧ����ˮ��������ԭ�ӵ��ṩ�ߣ���18O����CH3CH2OH�У���д���ܱ�ʾ18Oλ�õĻ�ѧ����ʽ ��
��2�����θ����C�������� �� ����Ӧǰ��D�м��뼸�η�̪����Һ�ʺ�ɫ�������������ԭ���ǣ������ӷ���ʽ��ʾ��������Ӧ������D�е������� ��
��3����D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ���������ټ�����ˮ�����ƣ�Ȼ����������ռ���Ʒ��������ʱ���¶�Ӧ���������ң�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ�������������ǣ� ��
A.CH3 CH2CH3
B.CH3 CH2CH2��
C.��CH2CH2CH2��
D.��CH3 ��2CH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com