
| A、X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B、Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
- 4 |
| c(H2C2O4) | ||
c(HC2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯净的盐酸是纯净物 |
| B、盐酸就是液态氯化氢 |
| C、盐酸中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等 |
| D、浓盐酸有腐蚀性,稀盐酸没有腐蚀性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,有关说法正确的是( )| A、电极2发生氧化反应 |
| B、电池工作时,Na+向负极移动 |
| C、电流由电极1经外电路流向电极2 |
| D、电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:7 |
| B、2:2:5 |
| C、3:1:4 |
| D、5:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol AlCl3在熔融状态时离子总数为0.4NA |
| B、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |
| C、2.2g分子式为 2H218O的水中含有的中子数为1.2 NA |
| D、电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
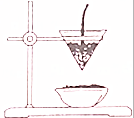 下图为教材铝热反应演示实验示意图
下图为教材铝热反应演示实验示意图查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com