


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、H2SO3是弱酸,所以Na2SO3是弱电解质 |
| B、SO3可以使品红、FeCl3溶液退色,分别体现了它的漂白性和还原性 |
| C、因为H2SO4溶液和Na2SO4溶液均具有良好的导电性,所以H2S04和Na2SO4均是离子化合物 |
| D、100mL 18.4mol?L-1的浓硫酸与足量铜在加热的条件下充分反应可产生9.2mol SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
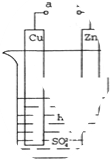 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nsnnpn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
| ⑦H能形成红色(或砖红色)的H2D和黑色的HD两种化合物. |

查看答案和解析>>
科目:高中化学 来源: 题型:
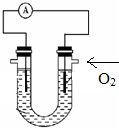 C、N、S的单质和化合物在工农业生产中有重要的应用.
C、N、S的单质和化合物在工农业生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
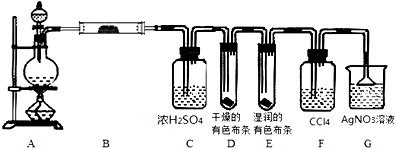
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol?L-1) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol?L-1) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中共消耗2amol水 | ||
| B、剩余溶液中有大量蓝色沉淀产生 | ||
C、剩余溶液中溶质的质量分数为
| ||
D、剩余溶液中溶质的质量分数为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com