
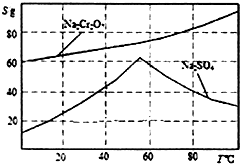
 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).分析 (1)依据化学方程式4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,分析反应过程中元素化合价变化,计算电子转移总数得到
(2)Na2CrO4中加入硫酸酸化,得到Na2Cr2O7和Na2SO4混合溶液,根据电荷守恒和元素守恒可书写离子方程式;酸性条件下Cr2O72-能将Cl-氧化成氯气;
(3)由图可知,温度高有利于硫酸钠结晶析出,所以要分离出Na2SO4,则必须的实验操作是蒸发浓缩、趁热过滤;滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(4)①用Na2S2O3标准溶液滴定碘溶液,由于Na2S2O3溶液显碱性,所以要将置于碱式滴定管中,滴定终点时,溶液的蓝色褪去,据此判断;
②根据电子得失守恒有关系式Na2Cr2O7~3I2~6Na2S2O3,根据关系式结合Na2S2O3的物质的量可计算出Na2Cr2O7的质量,进而确定产品中的Na2Cr2O7的质量分数.
解答 解:(1)4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,反应中依据元素化合价变化可知,氧气是氧化剂,7mol氧气反应得到电子28mol,所以生成8molNa2CrO4转移的电子数28mol,生成1mol Na2CrO4转移的电子数为3.5mol,
故答案为:O2;3.5;
(2)Na2CrO4中加入硫酸酸化,得到Na2Cr2O7和Na2SO4混合溶液,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O,酸性条件下Cr2O72-能将Cl-氧化成氯气,而损失目标产物,所以不能用盐酸酸化,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;酸性条件下Cr2O72-能将Cl-氧化而损失目标产物;
(3)由图可知,温度高有利于硫酸钠结晶析出,所以要分离出Na2SO4,则必须的实验操作是蒸发浓缩、趁热过滤;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:趁热过滤;冷却结晶;
(4)①用Na2S2O3标准溶液滴定碘溶液,由于Na2S2O3溶液显碱性,所以要将置于碱式滴定管中,判断达到滴定终点的依据是当滴加最后一滴Na2S2O3溶液时,溶液蓝色褪去,半分钟内不变色,
故答案为:碱式滴定管;当滴加最后一滴Na2S2O3溶液时,溶液蓝色褪去,半分钟内不变色;
②根据电子得失守恒有关系式Na2Cr2O7~3I2~6Na2S2O3,测定中消耗的Na2S2O3的物质的量为0.04L×0.1200mol•L-1=0.0048mol,所以Na2Cr2O7的质量为0.0048mol×$\frac{1}{6}$×262g/mol=0.2096g,所以产品中的Na2Cr2O7的质量分数为$\frac{0.2096g}{0.2500g}$×100%=83.84%,
故答案为:83.84%.
点评 本题考查了物质制备的流程分析判断,物质性质和实验操作的分析应用,把握晶体析出的原理和溶解度变化特征的分析是解题关键,题目难度中等,侧重于考查学生的实验能力、分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
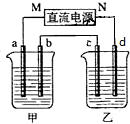 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
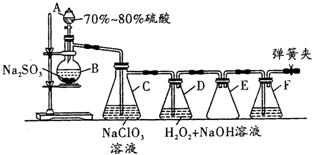 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: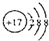 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: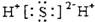 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
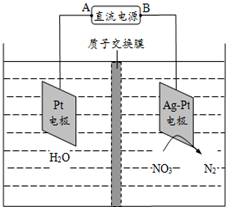
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com