
【题目】在一定条件下反应xA+yB![]() zC达到平衡。下列说法中正确的是
zC达到平衡。下列说法中正确的是
A.若C是气体,且x+y=z,则增大压强平衡一定不移动
B.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x+y<z
C.若B、C都是气体,其它条件不变,增大A的物质的量平衡不移动,则A为固态或液态
D.若升高温度C的质量分数减少,则正反应是吸热反应
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与C形成的化合物AC2的电子式是__________。
(2) 下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() (△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
⑴反应的化学方程式中a∶b∶c为;
⑵A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;
⑶B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
⑷由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
⑸比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3(填“<”“>”“=”)判断的理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气的物质的量为2摩尔
B.2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍
C.25 ℃,1.01×105Pa, 64g的SO2中含有的原子数为3NA
D.l摩尔任何物质所含的分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2![]() N2O4
N2O4![]() )
)
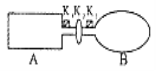
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)________(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将________(填“增大”、“减小”、“不变”)。
(2)若平衡后在A、B中再充入与初始量相等的NO2,则达到平衡时,A中的NO2转化率________,B中的NO2转化率将________(填“增大”、“减小”、“不变”);若通入等量的Ne气,则达到平衡时,A中的NO2转化率________,B中的NO2转化率将________(填“增大”、“减小”、“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,____________中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时的N2O4物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法中不正确的是( )
A. 合金比纯金属具有较好的性能,一般情况下,硬度比纯金属高,熔点比纯金属的低
B. 合金仍然具有金属特性
C. 常用电解法冶炼钠、镁、铝等活泼金属
D. 将钢闸门与电源正极相连,可防止其在海水中被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
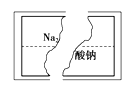
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知还取性:SO32->I-。向含有amolKI和amolK2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A. 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B. 当 5a="4b" 时,发生的离子反应为 4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C. 当 a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为 amol≤n(e-)≤3amol
时,反应中转移电子的物质的量n(e-)为 amol≤n(e-)≤3amol
D. 当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期常见元素形成的纯净物A、B、C、D转化关系如图1琐事,物质A与物质B之间的反应不再溶液中进行。

若A为金属单质,C是淡黄色固体,D是一元强碱。
①物质B是__________(填化学式)。
②化合物C的电子式为_________;化合物D中所含化学键的类型是_________。
③在常温下,向PH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是:__________.
(2)若A为非金属单质,C是有色气体,D是一元强酸.
①B为__________(填化学式)。
②化合物C与H2O反应化学方程式___________,氧化剂与还原剂的量比为_________。
(3)某同学用图2装置完成有关探究实验。
Ⅰ试管中发生反应的离子方程式为__________。
Ⅱ试管中观察到__________的实验现象时,说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com