
下列叙述正确的是( )
A.元素的相对原子质量是小数,是由于元素具有同位素
B.有相同质子数的原子或离子一定属于同种元素
C.K+和Ar具有相同的电子层结构,氧化性K+比Ar强
D.金属离子的电子层数一定比金属原子的电子层数少
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示。F和J是中学化学中常见的两种单质。H为红棕色气体。图中部分反应条件及生成物没有列出。请按要求填空:
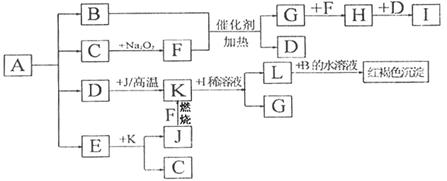
(1)单质F的化学式
(2)写出B和F反应的化学方程式 ,L和B的水溶液反应的离子方程式 ;
(3)写出K与I的稀溶液反应的离子方程式
(4)A的化学式为
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G生成,该反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些重要工业生产的转化关系(反应条件略去)。
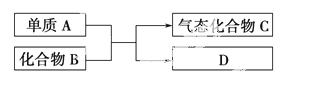
请完成下列问题:
(1)若D是单质,且与A属于同一主族,则:
①反应的化学方程式是_____________________________________________
_______________________________。
②D的原子结构示意图是________。
③D单质的一种重要用途是_________________________ _______________________________。
_______________________________。
(2)若B为黄色固体,D为固体化合物,则:
①该反应的化学方程式是 ___________________________________________________。
___________________________________________________。
②生产该工业品的工厂应建在离________较近的地方。
③实验室检验C的方法是______________________________________________________。
(3)若B是一种有刺激性气味的气体,则:
①B分子的空间构型为________。
②实验室进行此实验时,常看到有大量白烟 产生,产生大量白烟的原因是___________________________________________
产生,产生大量白烟的原因是___________________________________________ _________________。
_________________。
③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的 。请写出该反应的化学方程式________________________________________________________。
。请写出该反应的化学方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 1 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)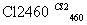 SiCl4
SiCl4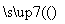 SiCl4(纯)
SiCl4(纯)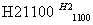 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________________________________
______ __________________________________________________________________。
__________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
___________________________________________________________________ _____。
_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
同周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4︰3,Z原子比X原子的核外电子数多4。下列说法正确的是 ( )
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z 形成的分子的空间构型可能是正四面体
形成的分子的空间构型可能是正四面体
D.WY2分子中σ键与π键的数目之比是2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含这三种元素的化学式:
①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4
⑤X3YZ4 ⑥XYZ3,其中可能存在的是( )
A.② B.②④⑤
C.②⑤⑥  D.①②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质均为只含两种元素的化合物,且均含18个电子。下列有关这四种物质的推断,正确的是( )
A.可能在某种物质中含有离子键
B.四种物质都是共价化合物
C.四种物质都不可能具有强氧化性
D.有一种物质是乙烷的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:
①铜与浓硫酸直接反应,即Cu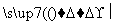 CuSO4
CuSO4
②Cu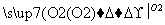 CuO
CuO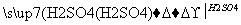 CuSO4
CuSO4
试回答下列问题:
(1)方案①的化学方程式是___________________________________。
(2)这两种方案中,你认为第________种方案较为合理(填序号)。
(3)试从原料用量和环境保护两方面阐述你所选用方案的合理理由是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用含淀粉的物质制备陈醋(醋酸)的主要过程,可用化学方程式表示为:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________;
④2CH3CHO+O2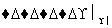 2CH3COOH。
2CH3COOH。
检验所酿的陈醋中是否含有淀粉的方法是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com