
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
分析 A.根据相对分子质量计算水的物质的量,根据原子组成计算中子数;
B.同素异形体首先应该是指单质,其次要强调是同种元素;
C.同位素:质子数相同、中子数不同的同一元素的不同核素.把握好两要素:同一元素、不同核素;
D.金刚石和石墨互为同素异形体,两者之间的转化属于化学变化.
解答 解:A.11g由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的水的物质的量为$\frac{11g}{22g/mol}$=0.5mol,含中子数为:0.5×(10+2×1)×NA=6NA,故A正确;
B.H2O和D2O是化合物,不是单质,故B错误;
C.${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3是氧元素的两单质,互为同素异形体,不是同位素,故C错误;
D.金刚石和石墨碳原子排列方式不同,是两种不同的单质,互为同素异形体,两者之间的转化属于化学变化,故D错误;
故选A.
点评 本题考查阿伏加德罗常数、同位素、同素异形体的判别等知识,题目难度不大,注意物质的量公式的熟练应用以及同位素、同素异形体的概念辨析.


科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 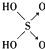 | 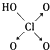 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
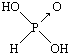 和
和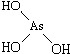 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
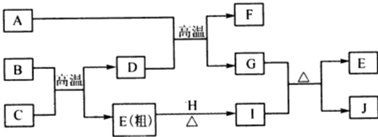
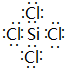 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
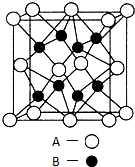 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

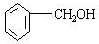 ;
; ;
;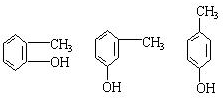
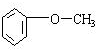 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和苯 | |
| B. | 用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| C. | 用新制的氢氧化铜悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用溴的四氯化碳溶液鉴别裂解气和焦炉气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com