
分析 (1)碳酸钠溶液水解显碱性,油污在碱溶液中发生水解生成溶于水的醇和盐,容易洗去;
(2)溶液②中存在物料守恒.n(Na)=n(C);
(3)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L;
(4)取④NH3•H2O的溶液5mL,向其中加入含0.1molNH4NO3的溶液后呈中性,结合溶液中电荷守恒确定氢氧根离子浓度为10-7mol/L,c(NH4+)=c(NO3-)=$\frac{0.1mol}{0.005L}$=20mol/L,结合平衡常数表达式计算得到Kb.
解答 解:(1)碳酸钠溶液水解显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)溶液②NaHCO3中存在物料守恒,溶液中碳元素所有存在形式浓度总和等于钠离子浓度,得到c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+)=0.1mol/L,
故答案为:0.1;
(3)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12 mol•L-1;
(4)取④的溶液5mL,向其中加入含0.1molNH4NO3的溶液后呈中性,结合溶液中电荷守恒确定氢氧根离子浓度为10-7mol/L,c(NH4+)=c(NO3-)=$\frac{0.1mol}{0.005L}$=20mol/L,Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{20×1{0}^{-7}}{0.1}$=2×10-5,
故答案为:2×10-5.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
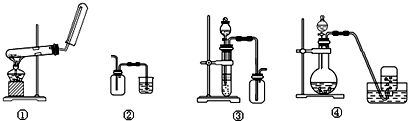
| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 即是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、OH-、Cl- | B. | SO42-、Mg2+、Cl-、Na+ | ||
| C. | SO42-、Na+、Mg2+、SO32- | D. | Cl-、SCN-、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3可用作高温耐火材料 | |
| B. | 利用漂白粉的氧化性漂白织物 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 在医疗上碳酸氢钠可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
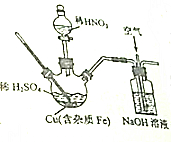 磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:
磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
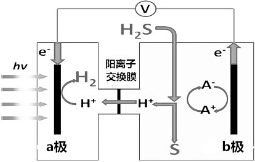
| A. | 该制氢工艺中光能最终转化为化学能 | |
| B. | 该装置工作时,H+由a极区流向b极区 | |
| C. | b极上发生的电极反应为Fe3++e-═Fe2+ | |
| D. | b极区需不断补充含Fe3+和Fe2+的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
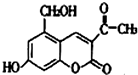 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )| A. | “亮菌甲素”的分子式为C12H10O5 | |
| B. | 1mol“亮菌甲素”与溴水的反应,最多消耗3mol Br2 | |
| C. | 1mol“亮菌甲素”最多能和6mol H2发生加成反应 | |
| D. | 1mol“亮菌甲素”最多能和2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32- | B. | Ba2+、SO42-、Cl- | C. | K+、H+、OH- | D. | Ag+、Al3+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com