
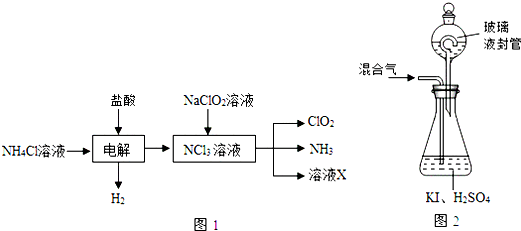
分析 (1)①实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过图1过程制备ClO2:由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;
②由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止残留的有害气体ClO2逸出;
③淀粉遇碘单质变蓝;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
解答 解:(1)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②a.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故a错误;
b.浓硫酸可以吸收氨气,且不影响ClO2,故b正确;
c.碱石灰不能吸收氨气,故c错误;
d.ClO2易溶于水,不能利用浓食盐水吸收氨,故d错误;
故答案为:b;
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),
故答案为:吸收残留的ClO2气体(避免碘的逸出);
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,
故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟内不变色;
④含有Na2S2O3物质的量为0.02 L×0.2mol/L=0.004 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.004mol
所以n(ClO2)=0.0008mol,所以m(ClO2)=0.008 mol×67.5g/mol=0.05400g,
故答案为:0.05400.
点评 本题考查制备ClO2、物质含量的测定,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H═-571.6kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-802.3kJ•mol-1 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
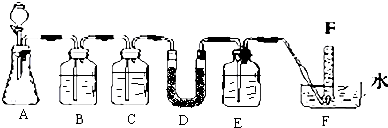
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 除去CO2中的水蒸气 | |
| E |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 用重结晶法分离碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
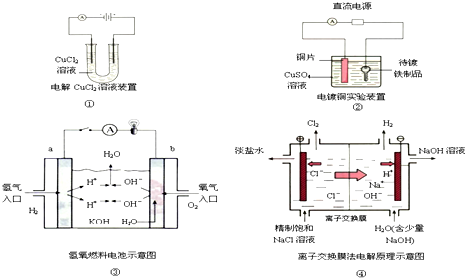
| A. | 装置①中阴极反应式为:2Cl--2e-═Cl2↑,阳极反应式为:Cu2++2e-═Cu | |
| B. | 装置②中铜片为阳极,若开始时铜片和铁制品的质量相等,电解一段时间后,电路中有2 mol电子转移,此时铜片和铁制品的质量差为128 g | |
| C. | 装置③中b极为负极,该极的电极反应方程式为O2+2H2O+4e-═4OH- | |
| D. | 装置④中阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与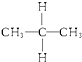 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); 和
和 ;⑧
;⑧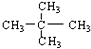 和
和 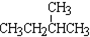 ;
;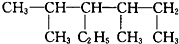 2,4-二甲基-3-乙基己烷
2,4-二甲基-3-乙基己烷 .该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为
.该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为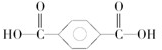 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com