
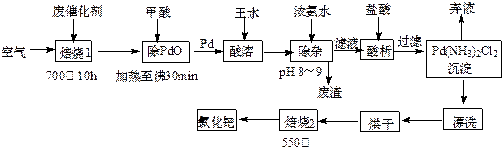
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:不详 题型:填空题
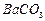 、
、 、
、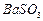 、
、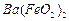 等]。某化工厂主要生产
等]。某化工厂主要生产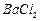 、
、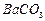 、
、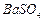 ,现利用钡泥制取
,现利用钡泥制取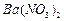 ,其部分工艺流程如下:
,其部分工艺流程如下: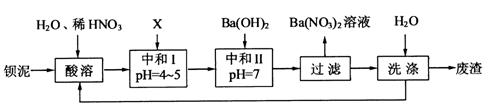
 ,
,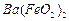 与
与 的反应化学方程式为 。
的反应化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3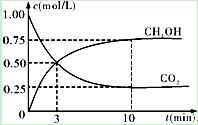
| A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1 |
| B.0~10min内,氢气的平均反应速率为0.075mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 元素的质量分数为26.7%,其余为N、S。
元素的质量分数为26.7%,其余为N、S。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率 |
| B.合成氨工业对原料气进行压缩,可增大原料气的转化率 |
| C.硫酸工业中,采取通入适当过量的空气,以提高SO2的转化率 |
| D.硫酸工业中,在催化反应室安装热交换装置可利用SO3转化为H2SO4时放出的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。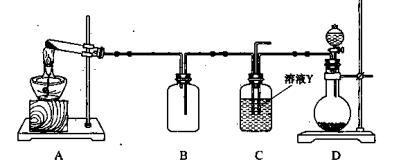
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤的气化是化学变化,煤的液化是物理变化 |
| B.甲烷是一种清洁燃料,可用作燃料电池的燃料 |
| C.蔗糖与淀粉水解的最终产物都是葡萄糖 |
| D.石油分馏可以得到乙烯、丙烯、甲烷等化工原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com