
分析 反应开始时A、B的体积之比为5:2,设反应起始时A、B物质的量分别是5mol、2mol,该反应前后气体的物质的量不变,故达到平衡时混合气体为7mol,平衡时C的体积分数是60%,故n(C)=(5+2)mol×60%=4.2mol,
(1)根据方程式知,参加反应的△n(A)=$\frac{2}{3}$△n(C)=$\frac{2}{3}$=2.8mol,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(2)根据质量守恒定律,可知平衡时混合气体总质量等于起始时A、B质量之和,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
(3)恒温恒容条件下,气体的压强之比等于物质的量之比.
解答 解:(1)反应开始时A、B的体积之比为5:2,设反应起始时A、B物质的量分别是5mol、2mol,该反应前后气体的物质的量不变,故达到平衡时混合气体为7mol,平衡时C的体积分数是60%,故n(C)=(5+2)mol×60%=4.2mol,根据方程式知,参加反应的△n(A)=$\frac{2}{3}$△n(C)=$\frac{2}{3}$×4.2mol=2.8mol,故A的转化率=$\frac{2.8mol}{5mol}$×100%=56%,
答:A的转化率为56%;
(2)根据质量守恒定律,可知平衡时混合气体总质量等于起始时A、B质量之和,故混合气体总质量为(5a+2b)g,则平均摩尔质量为$\frac{(5a+2b)g}{7mol}$=$\frac{5a+2b}{7}$g/mol,故平均相对分子质量为$\frac{5a+2b}{7}$g/mol,
答:平均相对分子质量为$\frac{5a+2b}{7}$;
(3)恒温恒容条件下,气体的压强之比等于物质的量之比,反应前后气体的物质的量不变,则压强不变,答:平衡时压强与起始时相比,压强不变.
点评 本题考查化学平衡有关计算,侧重考查学生分析及计算能力,明确反应中气体物质的量不变是解本题关键,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:多选题
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某温度下:
已知某温度下: (g)?
(g)? (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol. (g)?
(g)? (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
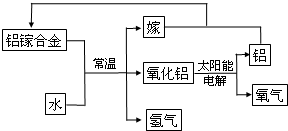 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com