
【题目】(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
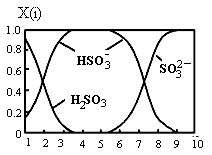 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)

【答案】(1)SO2+OH-=HSO3-
(2)①c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);②因为亚硫酸氢根离子存在电离平衡HSO3-![]() H++ SO32-,加入氯化钙后,Ca2++ SO32-= CaSO3↓,使平衡正向移动,氢离子浓度增大,pH减小;
H++ SO32-,加入氯化钙后,Ca2++ SO32-= CaSO3↓,使平衡正向移动,氢离子浓度增大,pH减小;
(3)NO+3Ce4++2H2O=NO3-+ 3Ce3++4 H+, NO+Ce4++H2O=NO2-+ Ce3++2 H+;
(4)a;2HSO3-+2e-+2H+= S2O42-+2H2O;
(5)243a或5600a/23
【解析】
试题分析:(1)根据流程图可知,二氧化硫与NO的混合气体与氢氧化钠溶液反应主要生成亚硫酸氢钠,所以装置Ⅰ中的主要离子方程式为SO2+OH-=HSO3-;
(2)①由图可知,pH=8时溶液中主要的阴离子是亚硫酸根离子,说明二氧化硫与氢氧化钠溶液反应主要生成亚硫酸钠,其次还有少量的亚硫酸氢钠,则溶液中离子浓度的大小关系是c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,溶液的酸性增强,因为亚硫酸氢根离子存在电离平衡HSO3-![]() H++ SO32-,钙离子与亚硫酸根离子结合为亚硫酸钙沉淀,促进亚硫酸氢根离子的电离,氢离子浓度增大,pH减小;
H++ SO32-,钙离子与亚硫酸根离子结合为亚硫酸钙沉淀,促进亚硫酸氢根离子的电离,氢离子浓度增大,pH减小;
(3)装置II是Ce4+与NO的反应,将NO氧化为硝酸根离子和亚硝酸根离子,自身被还原为Ce3+,离子方程式是NO+3Ce4++2H2O=NO3-+ 3Ce3++4 H+, NO+Ce4++H2O=NO2-+ Ce3++2 H+;
(4)装置Ⅲ还可以使Ce4+再生,则Ce3+被氧化为Ce4+,阳极发生氧化反应,所以Ce4+从电解槽的a口流出;阴极发生还原反应,根据流程图可知,HSO3-得到电子生成S2O42-,则电极反应式是2HSO3-+2e-+2H+= S2O42-+2H2O;
(5)NO2-与氨气、氧气反应生成硝酸铵,则N元素被氧化,化合价从+3价升高到+5价,1m3的溶液中的NO2-的物质的量是1000L×ag/L/46g/mol=1000a/46mol,失去电子的物质的量是1000a/46×2mol=,根据得失电子守恒,则需要氧气在标准状况下的体积是1000a/23mol/4×22.4L/mol=5600a/23L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.KCl=K++Cl-B.MgCl2=Mg2++Cl2-
C.KOH=K++O2-+H+D.H2SO4=H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C.830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆
D.830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从根本上减少乃至杜绝污染。下列对我们学习使用的纸张的处理方法,不符合“绿色化学”的是( )
A.一纸多用,尽量提高纸张的使用效率B.回收处理,不乱扔、乱丢废纸屑
C.在高浓度氧气中燃烧,不产生废弃物D.积累、保存送造纸厂处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性. 物质 ![]() 有光学活性,发生下列反应:
有光学活性,发生下列反应:
①与乙酸发生酯化反应 ②与NaOH水溶液反应 ③在Cu作催化剂时与O2反应 ④与银氨溶液反应.发生哪些反应后生成的有机物无光学活性(填写符合题意的字母编号)
A.只有①②
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( ) 
A.1 mol X在一定条件下最多与8 mol H2加成
B.1 mol X在一定条件下最多能与2 mol NaOH反应
C.X中有二种含氧官能团,酸性条件下水解产物中也有二种含氧官能团
D.X分子式为C16H12O4 , 和乙醇发生反应生成分子式为C18H18O5的酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 常温下电离常数为Ka的酸HA的溶液中c(H+)=![]() mol/L
mol/L
C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的c(H+)=10-7mol/L
D. 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com