
分析 (1)中和滴定发生酸碱中和反应,需要酸碱指示剂判定滴定终点;
(2)过滤是将固体不溶物跟液体分离的一种方法,其装置由铁架台、烧杯、玻璃棒、漏斗、滤纸等仪器和用品组成.
解答 解:(1)在酸碱中和滴定的过程中,需要的试剂有酸液、碱液和酸碱指示剂,需用蒸馏水洗涤滴定管和锥形瓶,故还需要的是蒸馏水和酸碱指示剂,故答案为:蒸馏水和指示剂;
(2)过滤是将固体不溶物跟液体分离的一种方法,其装置由铁架台、烧杯、玻璃棒、漏斗、滤纸等仪器和用品组成,即为①④⑤⑦⑨,故答案为:①④⑤⑦⑨.
点评 本题主要考查了中和滴定操作、以及过滤,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握常见实验操作的方法,原理以及使用仪器和注意事项,难度不大.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题

 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
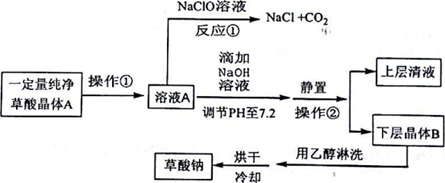
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
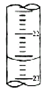 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
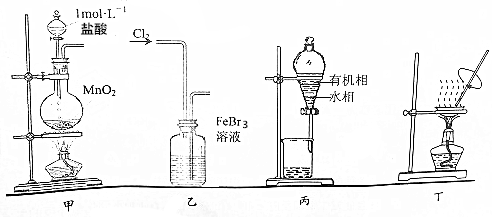
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙氧化FeBr3溶液中的溴离子 | |
| C. | 用装置丙分液时先从下口放出水相,再从上口倒出有机相 | |
| D. | 用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液 | B. | AlCl3溶液 | C. | MgCl2溶液 | D. | BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com