
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的 ![]() )、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆.活塞先左弹,恢复室温后,活塞右滑停留于容器的中央.则原来H2、O2 的物质的量之比可能为:①4:5 ②2:5 ③3:8 ④7:2( )
)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆.活塞先左弹,恢复室温后,活塞右滑停留于容器的中央.则原来H2、O2 的物质的量之比可能为:①4:5 ②2:5 ③3:8 ④7:2( ) 
A.①②
B.①④
C.②③
D.③④
【答案】B
【解析】解:令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2 ![]() 2H2O,
2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则: ![]() ,解得x:y=7:2,
,解得x:y=7:2,
若氧气过量,则: ![]() ,解得x:y=4:5,
,解得x:y=4:5,
故选B.
反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.


科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )
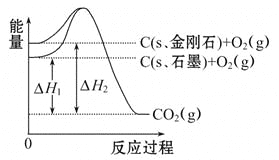
A. C(s、石墨)=C(s、金刚石)ΔH=+1.9 kJ·mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的能量比1 mol金刚石的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
B.某特定反应的平衡常数仅是温度的函数
C.通常情况下,一个放热且熵增的反应也有可能非自发进行
D.需要加热或点燃才能进行的反应不一定是非自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取高纯MnO2的流程如下:

(1)酸浸时所发生主要反应的离子方程式为_____________。
(2)酸浸时加入一定体积的硫酸,硫酸浓度不能过小或过大。当硫酸浓度偏小时,酸浸时会有红褐色渣出现,原因是_______。硫酸浓度不能过大的原因是_____________。
(3)过滤Ⅱ所得滤渣为MnCO3,滤液中溶质的主要成分是_____。
(4)焙烧MnCO3的装置如下图所示:

①焙烧时所发生反应的化学方程式为__________。
②焙烧一定时间后需转动石英管,目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:

已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与自然界中的许多变化一样,化学反应具有方向性。下列有关叙述中正确的是
A.原电池反应一定是自发进行的氧化还原反应,且△H<0
B.ΔH<0,ΔS<0的反应肯定能自发进行
C.体系能量增大和混乱度增大都有促使反应自发进行的倾向
D.CaCO3(s) =CaO(s)+CO2(g)的ΔH>0,ΔS<0,该反应在较高温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A. 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
B. 1mol C10H22分子中共价键总数为32NA
C. 合成氨反应达到平衡时,当1NA N≡N形成的同时,就有6NA N-H键形成
D. 1L浓度为1mol/L的碳酸钠溶液中含有3NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由乙烯推测丙烯的结构或性质不正确的是( )
A. 分子中所有原子都在同一平面上 B. 乙烯的沸点比丙烯低
C. 能与H2O、HCl发生加成反应 D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com