
 化学实验是研究物质性质的基础.
化学实验是研究物质性质的基础.| n |
| V |
| 5 |
| 2 |
| 2.5V×10-4mol |
| 0.02L |


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g铜被氧化,失去的电子数一定为2NA |
| B、室温下,pH=13的氨水中,由水电离的OH-浓度为0.1mol?L-1 |
| C、在标准状况下,22.4LC4H10中共价键数目一定为13NA |
| D、200mL 1mol?L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(OH-)+c(H2CO3)=c(H+)+c(CO32-) |
| C、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4-)>c(H+)>c(OH-) |
| D、常温下向醋酸钠溶液中加少量醋酸使溶液pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | NO | 甲 | 乙 |
| 0 | 0.200 | 0 | 0 |
| 10 | 0.116 | 0.042 | 0.042 |
| 20 | 0.080 | 0.060 | 0.060 |
| 30 | 0.080 | 0.060 | 0.060 |
| ClO2 |
| 反应I |
| Na2SO3水溶液 |
| 反应II |
查看答案和解析>>
科目:高中化学 来源: 题型:
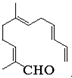 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置组成一种原电池.试回答下列问题:
如图所示装置组成一种原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com