
����Ŀ����̼�Ļ�����֮���������ת������ش��������⣺
��1���л��� M ���й��ʱ�������ת���� N���������ͼ��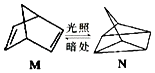
M �� N �����У�����ת��Ϊ�ܣ����н��ȶ������������� M��N �ش𣩣�
��2����֪ ![]() ��l����ȼ����Ϊ 3267.5kJmol��1 ��
��l����ȼ����Ϊ 3267.5kJmol��1 �� ![]() ��l��+6O 2��g���T6CO2 ��g��+3H2 ��g��
��l��+6O 2��g���T6CO2 ��g��+3H2 ��g��
��H=a kJmol��1 �� �� a��3267.5�����������������=������
��3���ڱ�״̬��ѹ��Ϊ 100kPa��һ���¶��£���Ԫ�����ȶ��ĵ����������� 1mol ���� ����ʱ�ķ�Ӧ�ȳ�Ϊ�û�����ı�Ħ�������ʣ���H��������֪ 100kPa��һ���¶��£�
Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H=+490.0kJmol��1
CO��g��+ ![]() O2��g��=CO 2��g����H=��280.0kJmol��1
O2��g��=CO 2��g����H=��280.0kJmol��1
C��ʯī��+O2��g��=CO2 ��g����H=��390.5kJmol��1
�� Fe2O3�ı�Ħ�������ʡ�H= ��
���𰸡�
��1����ѧ,M
��2����
��3����821.5KJ/mol
���������⣺��1��M�����˹���������N������ת����ʽΪ����ת��Ϊ��ѧ�ܣ���ӦΪ���ȷ�Ӧ��M��������N����M�������ȶ���
���Դ��ǣ���ѧ��M��
��2����2����֪ ![]() ��l����ȼ����Ϊ3267.5kJmol��1��
��l����ȼ����Ϊ3267.5kJmol��1�� ![]() ��l��+
��l��+ ![]() O2��g���T6CO2��g��+3H2O��l����H=��3267.5kJmol��1��
O2��g���T6CO2��g��+3H2O��l����H=��3267.5kJmol��1��
![]() ��l��+6O2��g���T6CO2��g��+3H2��g����H=a kJmol��1������ȼ�շ��ȣ����ȷ�Ӧ���ʱ�Ϊ��ֵ����a����3267.5kJmol��1��
��l��+6O2��g���T6CO2��g��+3H2��g����H=a kJmol��1������ȼ�շ��ȣ����ȷ�Ӧ���ʱ�Ϊ��ֵ����a����3267.5kJmol��1��
���Դ��ǣ�����
��3����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H=+490.0kJmol��1
��CO��g��+ ![]() O2��g��=CO2��g����H=��280.0kJmol��1
O2��g��=CO2��g����H=��280.0kJmol��1
��C��ʯī��+O2��g��=CO2��g����H=��390.5kJmol��1
���ݸ�˹���ɼ��㣬 ![]() ���ۡ�3���٩��ڡ�3���õ�2Fe��s��+
���ۡ�3���٩��ڡ�3���õ�2Fe��s��+ ![]() O2��g��=Fe2O3��s����H=��821.5KJ/mol��
O2��g��=Fe2O3��s����H=��821.5KJ/mol��
���Դ��ǣ���821.5KJ/mol��
�����㾫�����������⣬������Ҫ�˽ⷴӦ�Ⱥ��ʱ�(�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ��)��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2C��s��+O2��g���T2CO��g����H=��221.0kJ��mol��1����Ȼ�ѧ����ʽ��ʾ�� ��
A.2g̼ȼ������һ����̼ʱ�ų�221.0kJ������
B.2mol̼ȼ������һ����̼ʱ����221.0kJ������
C.2mol����̼��������ȼ������2 molһ����̼����ʱ�ų�221.0kJ������
D.12g̼��������Ӧ����һ����̼ʱ�ų�221.0kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ�ζ���ȷ��ȡ25.00mL��ijδ֪Ũ�ȵ�������Һ��һ�ྻ����ƿ�У�Ȼ����0.20molL��1������������Һ��ָʾ��Ϊ��̪���ζ��ý�����
NaOH��ʼ���� | NaOH�յ���� | |
��һ�� | 0.10ml | 20.30ml |
�ڶ��� | 0.30ml | 20.10ml |
��1�������������ݿ��Լ������������ʵ���Ũ��Ϊ molL��1 ��
��2��������250mL0.20molL��1���������Ʊ���Һʱ���õ���������������ƽ���ձ������������� ��
��3�����²�����ɲⶨ���ƫ�ߵ��� ��
A.���Ʊ���Һ���������ƹ����л���KOH����
B.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
C.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
D.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
E.δ�ñ�Һ��ϴ��ʽ�ζ��ܣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ����
A.�Ҵ���C2H5OHB.2K��2����Ԫ��C.2��п���ӣ�2Zn��2D.60��̼ԭ�ӣ�C60
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ��װ�ã���Һ��A��μ��뵽����B�У�����������ȷ����

A. ��AΪH2O2��BΪMnO2��C��Na2S��Һ�����
B. ��AΪŨ���ᣬBΪMnO2��C��KI������Һ����ɫ
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��AlCl 3��Һ�Ȳ�����ɫ������ �������ܽ�
D. ��AΪŨ���� ��BΪCaCO3��C��Na2SiO3 ��Һ���ְ�ɫ��������ǽ�����C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 25��ʱ����������ʵĵ���ƽ�ⳣ�����������
��ѧʽ | HSCN | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.3��10��1 | 1.8��10��5 | Ka1=4.3��10��1Ka2=5.6��10��1 | 3.0��10��8 |
�ش��������⣺
��1��д��̼�����Ҫ�ĵ��뷽��ʽ �� ����̼�ᱥ����Һϡ�� 10 ������ϡ�ͺ����Һ�� c��H+��ԭ����ʮ��֮һ������ڡ�����С�ڡ����ڡ�����
��2�����ʵ���Ũ�Ⱦ�Ϊ 0.1mol/L ��������Һ��pH ��С�����˳��Ϊ���ñ����д����
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3 e��NaSCN
��3��25��ʱ���� 20mL0.1molL��1CH COOH ��Һ�� 20mL0.1molL��1HSCN ��Һ�ֱ��� 20mL0.1molL��1NaHCO ��Һ��ϣ�ʵ���ò��������������V����ʱ�䣨t���ı仯��ͼ��
��Ӧ��ʼ��������Һ���� CO2��������ʴ������Բ����ԭ������Ӧ�������� NaHCO3��ȫ��Ӧ������ȫ���ݳ�������������Һ�У�c��CH3COO��c��SCN�������������������=����
��4��25��ʱ��CH3COONa �� CH3COOH �Ļ����Һ������� pH=8������Һ��c��Na+����c��CH3COO����=mol/L����������ݺ�ļ���ʽ���������������ֵ����
��5���� NaClO ��Һ��ͨ�������� CO2 �� ������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡþ���ɰ����²�����У�
�ٰѱ����Ƴ�ʯ����
��������ĺ�ˮ�м���ʯ���飬���������ˣ�ϴ�ӳ�����
�۽������������ᷴӦ���ᾧ���ˣ��������
��ұ���۵IJ���õ�����Mg
������ȡþ������˵������ȷ����
A. �˷����ŵ�֮һ��ԭ����Դ�ḻ
B. ���Т٢ڢ۲����Ŀ���ǴӺ�ˮ����ȡMgCl2
C. �â۵IJ���ұ������Mg���������Ȼ�ԭ������ԭ��C��CO��H2��
D. ������ȡþ�Ĺ������漰�ķ�Ӧ�зֽⷴӦ�����Ϸ�Ӧ���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҩ��H ��ͨ�����ºϳ�·���Ʊ���

��֪: ![]()
��1��A���ʵ�����Ϊ_______________��B�к��������ŵ�����Ϊ__________________��
��2����B����C�ķ�Ӧ����Ϊ________________����E ����F �ķ�Ӧ����Ϊ_______________��
��3�������Լ������ڼ���![]() ��
��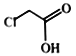 ����________(����)��
����________(����)��
a.NaOH ��Һ b.С�մ���Һ c.AgNO3��Һ d.���CCl4��Һ
��4����D����E�Ļ�ѧ����ʽΪ____________________________________��
��5����֪��������������ͨ���������Ӷ���(![]() )�������б�����ĵ�������������ת����B��ͬ���칹���к������������ܷ���������Ӧ��������____�֡�
)�������б�����ĵ�������������ת����B��ͬ���칹���к������������ܷ���������Ӧ��������____�֡�
��6��M(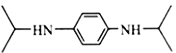 )���Ʊ��ϳ�Ⱦ�ϡ����ϵ���Ҫ�м�����������ϳ�·�ߣ����Ա�ͪ(
)���Ʊ��ϳ�Ⱦ�ϡ����ϵ���Ҫ�м�����������ϳ�·�ߣ����Ա�ͪ(![]() )�ͶԱ�����(
)�ͶԱ�����(![]() )Ϊ��Ҫ�л�ԭ�����M�ĺϳ�·��________________(�����Լ���ѡ)��
)Ϊ��Ҫ�л�ԭ�����M�ĺϳ�·��________________(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪K��Ka��KW��Ksp�ֱ��ʾ��ѧƽ�ⳣ��������ĵ���ƽ�ⳣ����ˮ�����ӻ����������ܵ���ʵ��ܶȻ�������
��1���й�����������˵����ȷ���� ��
a�����Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶�
b�����ǵĴ�С�����¶ȵ����߶�����
c�������£�CH3COOH��ˮ�е�Ka�����ڱ���CH3COONa��Һ�е�Ka
��2��25��ʱ��a molL��1�İ�ˮ��0.01molL��1�������������������Һ��c��NH4+��=c��Cl����������Һ������ᡱ��������С����ԣ��ú�a�Ĵ���ʽ��ʾNH3H2O�ĵ���ƽ�ⳣ��Kb=
��3����֪25��ʱCH3COOH��NH3 �� H2O���볣����ȣ�����¶���CH3COONH4��Һ��ˮ�����H+Ũ��Ϊ �� ��Һ������Ũ�ȴ�С��ϵΪ
��4��25��ʱ��H2SO3�THSO3��+H+�ĵ��볣��Ka=1��10��2molL��1 �� ����¶���pH=3��c��HSO3����=0.1molL��1��NaHSO3��Һ��c��H2SO3��= ��
��5����֪������Fe��OH��3��Mg��OH��2��Ksp�ֱ�Ϊ8.0��10��38��1.0��10��11 �� ��Ũ�Ⱦ�Ϊ0.1mol/L��FeCl3��MgCl2�Ļ����Һ�м����Һ��ҪʹFe3+��ȫ������Mg2+��������Ӧ�õ�����ҺpH�ķ�Χ�� �� ����֪lg 2=0.3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com