
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 A B C D E F
混
合
溶
液 4mol/LH2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
时间(min) 15 10 5 3 6 9
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因 ;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2: .
(4)请你设计实验验证上述假设1,完成下表内容.
实验方案(不要求写具体操作过程) 预期实验结果和结论
,
考点: 探究影响化学反应速率的因素.
分析: (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn,根据逻辑推理,假设2为Zn和Cu混合物;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立.
解答: 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成CuZn微电池,加快了氢气产生的速率;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn;
故答案为:既有Zn又有Cu;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立;
故答案为:
实验方案(不要求写具体操作过程) 预期实验结果和结论
取少量固体于试管中,滴加适量稀盐酸 若有气泡产生,假设1不成立;
若无气泡产生,假设2成立.
.
点评: 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(2)小题,首先V1、V6、V9的求得要注意分析表中数据;题目难度中等.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
下列说法中错误的是( )
|
| A. | 从1L 1mol•L﹣1的NaCl溶液中取出10mL,其浓度仍是1mol•L﹣1 |
|
| B. | 制成0.5L 10mol•L﹣1的盐酸,需标准状况下氯化氢气体112L |
|
| C. | 0.5L 2mol•L﹣1 BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023 |
|
| D. | 10g 98%硫酸(密度为1.84g•cm﹣3)与10mL 18.4 mol•L﹣1硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A~G是几种烃分子的球棍模型,据此回答下列问题:
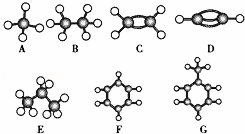
(1)如图七种烃中:
①常温下含氢量最高的气态烃是 (填对应结构简式).
②能够发生加成的烃有 种.
③分子中所有原子共面的是 (填对应字母).
④属于芳香烃的是 (填对应分子式)
(2)由D可制取重要的化工原料聚氯乙烯,其中涉及到的反应类型有2种,依次是 和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列溶液中粒子浓度大小关系正确的是()
A. Na2S溶液中,2c(Na+)=c(S2﹣)+c(HS﹣)+c(H2S)
B. 强碱弱酸盐NaA溶液的pH=8,则c(OH﹣)﹣c(HA)=1,0×10﹣8mol/L
C. KAl(SO4)2溶液中,c(SO42﹣)>c(K+)=c(Al3+)>c(H+)>c(OH﹣)
D. 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml
查看答案和解析>>
科目:高中化学 来源: 题型:
若要在铜片上镀银时,下列叙述中错误的是()
①将铜片接在电源的正极②将银片接在电源的正极③在铜片上发生的反应是:Ag++e﹣═Ag④在银片上发生的反应是:4OH﹣﹣4e﹣═O2+2H2O⑤可用CuSO4溶液作电解质溶液⑥可用AgNO3溶液作电解质溶液.
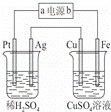
A. ①③⑥ B. ②③⑥ C. ①④⑤ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 2A=B+3C,在20℃时进行,v(A)=5mol/(L•s),已知每升温10℃,该反应速率增大到原来的2倍,则当其它条件不变而温度升到50℃时,反应速率v(B)是()
A. 20 mol/(L•s) B. 40 mol/(L•s) C. 60 mol/(L•s) D. 15 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()
A. 1:2:3 B. 3:2:1 C. 6:3:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似.下列关于“钴酞菁”分子的说法中正确的是()
A. 在水中所形成的分散系属悬浊液
B. 分子直径比Na+小
C. 在水中形成的分散系能产生丁达尔效应
D. “钴酞菁”分子不能透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com