
【题目】现有短周期主族元素X、R、Y、Z、T的原子半径与原子序数的关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的简单离子化合物不能破坏水的电离平衡。下列推断正确的是

A.氢化物的沸点一定是:Y>R
B.原子半径和简单离子半径均满足:Z>Y
C.最高价氧化物对应的水化物的酸性:R > T
D.X、R、Y、T四种元素两两之间均能形成共价化合物
【答案】D
【解析】
R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的化合物不能破坏水的电离平衡,T应为Cl;X的原子半径最小,原子序数最小,应为H元素,结合对应单质、化合物的性质以及题目要求解答该题.
由分析可知:X为H,Y为O,Z为Na,R为C,T为Cl;
A.Y的氢化物为水或双氧水,R为C,对应的氢化物为烃,如含碳原子数较多,常温下为固体,沸点较高,则氢化物的沸点不一定是:Y>R,故A错误;
B.电子层多的原子半径大,所以原子半径O<Na,核外电子排布相同的离子,核电荷数大的半径小,离子半径O2>Na+,故B错误;
C.非金属性Cl>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以高氯酸的酸性大于碳酸的酸性,故C错误;
D.由H、C、O、Cl四种元素可以形成CH4、H2O、HCl、CO、CCl4、ClO2等化合物,均为共价化合物,故D正确;
故答案选D。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】将43.2g FeC2O4隔绝空气加热,分解得到21.6g铁的氧化物,所得气体产物成分及物质的量是
A.0.3mol COB.0.3mol CO和0.3mol CO2
C.0.6mol CO2D.0.5mol CO和0.5mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),a、b为多孔石墨电极。闭合S1一段时间后,a附近溶液逐渐变红;断开S1,闭合S2,电流表指针发生偏转。
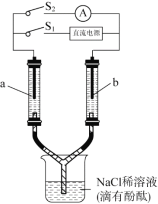
下列分析不正确的是
A.闭合S1时,a附近的红色逐渐向下扩散
B.闭合S1时, a附近液面比b附近的低
C.断开S1、闭合S2时,b附近黄绿色变浅
D.断开S1、闭合S2时,a上发生反应:H2 2e- = 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钠与氧气的反应会因条件不同而导致现象不同,产物不同,反应的实质也不同。据此回答下列问题:
①常温下,在空气中切开金属钠,钠的断面由银白色逐渐变暗而失去金属光泽,请用化学方程式解释这种现象产生的原因:__________________。
②钠在空气中受热所发生反应的化学方程式是__________________。
③将4.6克钠投入足量水中,标况下生成气体的体积是__________。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为____________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为___________________________________。
③实验室制备Al(OH)3的常用方法是向Al2(SO4)3溶液中逐滴滴加氨水至过量,请写出对应的化学方程式:___________________________________。
(3)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
①中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是_______。
②写出磁石的主要成分和盐酸反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
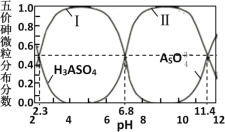
A.曲线Ⅱ代表HAsO![]() 的分布分数
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(s)+3Y(g) ![]() Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
A.在反应的过程中,加入更多的 X,化学反应速率加快
B.在反应的过程中,容器内的压强保持不变
C.相同时间内,消耗 0.1 mol X 的同时,生成 0.2 mol W,说明反应到达平衡状态
D.随着反应的进行,容器内气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与苯乙烯具有相同最简式但不是同系物
B.乙醚和乙醇互为同分异构体
C.CH3—C≡C—CH=CH—![]() —CH3分子中最多可以有20个原子共平面
—CH3分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3 和C(CH3)4互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com