
| He | ||
| F | ||
| S | Cl | |
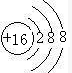
| A.非金属性:F>S>Cl | B.原子半径:Cl>S>F |
| C.稳定性:HF>HCl>H2S | D.酸性:HF>HClO4>H2SO4 |


科目:高中化学 来源: 题型:

| C | N | O | F | ||
| Si | P | S | Cl | ||
| Ge | As | Se | Br | ||
| Sn | Sb | Te | I | ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省六校高三第一次联考化学卷 题型:双择题
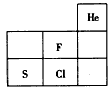
如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
|
|
He |
|
|
|
F |
|
|
S |
Cl |
|
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
| He | ||
| F | ||
| S | Cl | |
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
| He | ||
| F | ||
| S | Cl | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com