
(1)配平下列化学反应方程式
Cu2S + HNO3—— Cu(NO3)2 + H2SO4 + NO + H2O
(2)标出电子转移的方向和数目。
(3)在标准状况下生成2.24LNO时,转移电子物质的量为 。
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
| O | - 3 |
| O | 2- 8 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
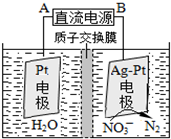 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
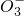 +______,
+______,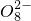 +H2O→Mn
+H2O→Mn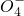 +S
+S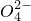 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河北省衡水中学高三(上)二调化学试卷(解析版) 题型:解答题
 +______,
+______, +H2O→Mn
+H2O→Mn +S
+S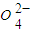 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com