
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
【答案】D
【解析】
A.在含有BaSO4沉淀的溶液中存在平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),加入Na2SO4固体,平衡逆向移动,c(Ba2+)减小,A错误;
Ba2+(aq)+SO42-(aq),加入Na2SO4固体,平衡逆向移动,c(Ba2+)减小,A错误;
B.若强酸为二元强酸,强碱为一元强碱,则混合后酸过量,溶液呈酸性,B错误;
C.含 1mol KOH 的溶液与 1mol CO2完全反应生成碳酸氢钾,由物料守恒知,c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3),C错误;
D.在醋酸钠溶液中,由于CH3COO-水解,使c(CH3COO-)比c(Na+)小些,加入适量醋酸后,醋酸能电离一定量的CH3COO-,有可能出现c(CH3COO-)=c(Na+),D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
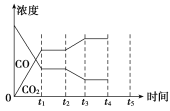
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
装置 | 实验现象 |
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,25 ℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随![]() 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

A.向Na2A溶液加入H2A过程中,水电离的c(OH-)不断增大
B.NaHA溶液中:c(H+)>c(OH-)
C.H2A的第二步电离常数的数量级为10-8
D.当吸收液呈中性时:c(Na+)=2c(A2-)+c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
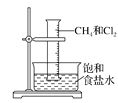
A. 该反应属于取代反应
B. 该反应的条件是光照
C. 该反应的生成物只有四种
D. 该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中 CO2 的含量及有效地开发利用 CO2,已受到各国的普遍重视。目前工业上有一种方法是用 CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为 1L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2 和 CH3OH(g)的浓度随时间变化如下图所示。
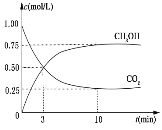
(1)在恒温恒容条件下,下列能说明反应达到化学平衡状态的是 _________(选填字母)
A.体系压强不再改变 B.气体密度不再改变 C.CO2 的浓度不再改变 D.v 正(CO2)= v 逆(H2)
(2) 从反应开始到平衡,氢气的平均反应速率 v(H2)=________mol/(L·min)。
(3)在该温度下,该反应的平衡常数为_________(保留小数点后 2 位)。
(4)下列措施中能使平衡体系中 n(CH3OH)/n(CO2)增大的是_________(选填字母)。
A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离出去 D.再充入 1mol H2
(5)当反应达到平衡时,H2 的物质的量浓度为 c1,然后向容器中再加入一定量 H2,待反应再一次达到平衡后,H2 的物质的量浓度为 c2,则 c1________________c2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所设计了一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
则8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,氨硼烷还可作燃料电池,其工作原理如图1所示。氨硼烷电池工作时正极的电极反应式为__________。

(3)常见含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,写出其化学方程式_______。![]() 为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
(4)燃油汽车尾气含有大量的NO,在活化后的V2O5催化作用下,氨气将NO还原成N2的一种反应历程如图3所示。

根据图写出总反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿![]() 主要成分是
主要成分是![]() 和少量的
和少量的![]() 、
、![]() 杂质
杂质![]() 是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取
是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取![]() 和铵明矾晶体
和铵明矾晶体![]() 的工艺流程如图所示:
的工艺流程如图所示:

请回答下列问题:
![]() 固体a的化学式为______,Ⅲ中反应的离子方程式为______。
固体a的化学式为______,Ⅲ中反应的离子方程式为______。
![]() 由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______
由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______![]() 填操作名称
填操作名称![]() 。
。
![]() 若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的![]() 和
和![]() 的物质的量之比为______。
的物质的量之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com