
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
【答案】过氧化钠 氢氧化钠 碳酸钠 2Na+2H2O==2Na++2OH-+H2↑ 2OH-+CO2==CO32—+H2O 2Na2O2+2H2O==4Na++4OH-+ O2↑ CO32—+2H+==CO2↑+H2O
【解析】
(1)淡黄色固体A能与二氧化碳、水反应,则A为Na2O2,A与水反应生成C,与二氧化碳反应生成D,且C与二氧化碳反应生成D,则C为NaOH、D为碳酸钠,B与水反应生成C,与氯气反应生成E,则B为Na,E为NaCl,故答案为:过氧化钠;氢氧化钠;碳酸钠;
(2)B→C的反应为钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O==2Na++2OH-+H2↑,故答案为:2Na+2H2O==2Na++2OH-+H2↑;
C→D的反应为氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,反应的离子方程式为:2OH-+CO2==CO32—+H2O,故答案为:2OH-+CO2==CO32—+H2O;
A→C的反应为过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O==
4Na++4OH-+ O2↑,故答案为:2Na2O2+2H2O==4Na++4OH-+ O2↑;
D→E的反应为碳酸钠与盐酸反应生成碳酸氢钠和氯化钠或二氧化碳、氯化钠和水,反应的离子方程式为:CO32—+H+==HCO3—或CO32—+2H+==CO2↑+H2O,故答案为:CO32—+H+==HCO3—或CO32—+2H+==CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】25℃时,Ksp[Mg(OH)2]=10-12,Ksp(MgF2)=10-10。下列说法正确的是( )
A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
B. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C. 25℃时,Mg(OH)2固体在20mL 0.01 molL-1氨水中的Ksp比在20mL 0.01 molL-1NH4Cl溶液中的Ksp小
D. 25℃时,欲用1L NaF溶液将0.05mol Mg(OH)2完全转化为MgF2,则c(NaF)≥1.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
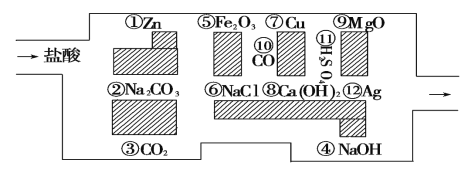
(1)请你帮助它走出迷宫(请用图中物质的序号先后连接起来表示所走的路线)_______________________ 。
(2)迷宫内12种物质中属于碱性氧化物的有 _____,写出其中一种与盐酸反应的离子方程式:_____。
(3)迷宫内 12 种物质中金属单质,按活动性顺序由强到弱是:_________,试写一个相互置换的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】户外运动常带便餐自热饭,其“发热包”遇水即可发热,原理主要是将化学能转化为热能,“发热包”中可能含有下列物质中的( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):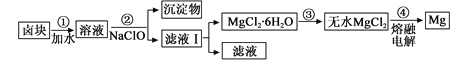
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为其中含有[Cu(H2O)4]2+,该离子的结构简式为______(标出配位键,不考虑空间构型)。向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水至沉淀刚全部溶解时可得到蓝色的[Cu(NH3)4SO4溶液,继续向其中加入乙醇会有蓝色晶体析出,原因是_______。
(2)新制Cu(OH)2悬浊液可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙酸的沸点高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中与中心Cu形成配位健的原子_________。BF4-的空间构型为_____,与其互为等电子体的分子是_____________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A。其结构如图所示。

①1mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_______。
②标出配合物A中的配位键________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
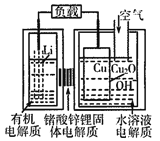
A. 该电池负极不能用水溶液作为电解质
B. 放电时,Li+透过固体电解质向Cu极移动
C. 通空气时铜被腐蚀,表面产生Cu2O
D. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有共价键的化合物一定是共价化合物
B.非金属元素之间不可能形成离子化合物
C.气体分子间一定存在分子间作用力,但分子内不一定含共价键
D.两种不同的非金属元素形成的化合物只存在极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com