
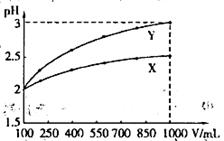
A.X为弱酸,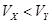 | B.Y为强酸,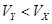 |
C.X为强酸,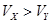 | D.Y为弱酸,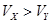 |
科目:高中化学 来源:不详 题型:单选题
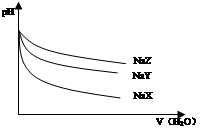
| A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ |
| B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-) |
| C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-) |
| D.在0.2mol·L-1 NaX溶液中加入等体积0.1mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
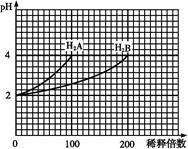
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分别加水稀释相同的倍数,稀释后两溶液pH仍相同 |
| B.NaOH溶液中水电离产生的c(OH-)较小 |
| C.用等浓度的盐酸完全中和,消耗盐酸体积相等 |
| D.加入少量NH4Cl(s),pH均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的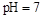 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C. 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3 COOH的电离平衡常数增大为原来的10倍 |
| B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍 |
| C.CH3 COO一与H十的浓度之积减小为原来的0.1 |
| D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
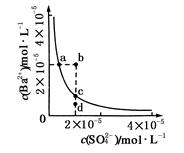
| A.NH3·H2O的电离程度减小 | B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 | D.溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com