
下列离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O
科目:高中化学 来源:2017届湖北省高三上学期8月月考化学试卷(解析版) 题型:选择题
下列各表述与示意图一致的是( )
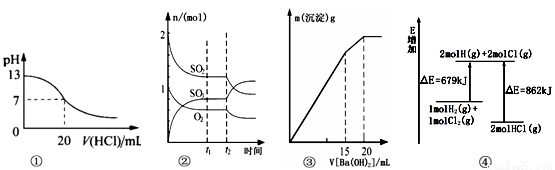
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g) + O2(g) 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积
2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+C12(g)== 2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:填空题
(1)在100 mL 0.8mol/L硝酸溶液中加入足量铜粉,则被溶解的铜的质量为____________g。
(2)在上述溶液中再加入足量稀硫酸,又有_______g铜溶解。此过程中生成的气体在标准状况下的体积为_________L。
(3)若向100 mL 0.8mol/L硝酸溶液中加入铁粉,测得反应后的溶液中Fe2+与Fe3+的浓度之比为1:1,则加入铁的质量为____________g。
(4)向100 mL 0.8mol/L硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出气体224mL(标准状况下),且测得溶液中铁元素只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1mol/L的NaOH溶液___________mL。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | - |
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
A~E是中学化学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
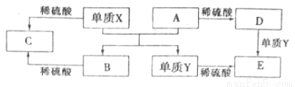
则下列说法正确的是
A.单质X与A反应的化学方程式:Al2O3+2Fe Fe2O3+2Al
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
①SO2、NO2都能和碱溶液发生反应属于酸性氧化物,Fe2O3、Al2O3属于碱性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可治疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤ B.④⑤⑥ C.②③④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:填空题
工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
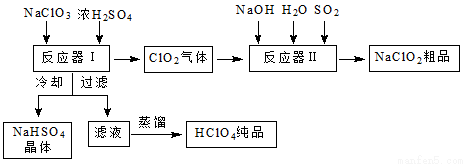
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是___________________。
(4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有__________,请写出工业上用氯气和消石灰生产漂粉精的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:选择题
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B.Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物
C.漂白粉、福尔马林、冰水、王水、氯水均为混合物
D.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期开学考试化学试卷(解析版) 题型:选择题
有八种物质:①甲烷、②苯、③聚乙烯、④乙烯、⑤2﹣丁炔、⑥己烷、⑦邻﹣二甲苯、⑧氯乙烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑧ B.④⑤⑧ C.③④⑤ D.④⑤⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com