
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
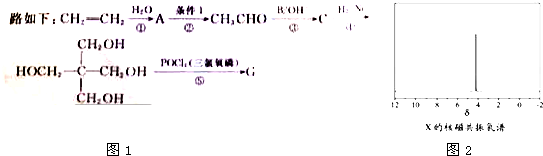

 )与
)与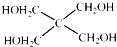 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com