
����Ŀ��Ӣ����ѧ��ϣ�����֣������Ҷ��������Һ�м����ʵ��ĵ�������(�������)���ڹ���ʱ��ʹˮ�ֽ���ͷ��������Ӷ�֤���������ͷ���CO2��ԭ�Dz�ͬ�Ĺ��̣����Թ�����õ��о�������ϸ�����档�÷�Ӧ����ʽΪ4Fe3++2H2O![]() 4Fe2++4H++O2���������й�ϣ����Ӧ˵��������ǣ� ��
4Fe2++4H++O2���������й�ϣ����Ӧ˵��������ǣ� ��
A. ˮ�ڹⷴӦ��������͵��ӹ���˫������
B. ��Ӧ����ҺpH��С
C. ���ɱ�״����11.2 L O2ʱ��Fe3+�õ�����Ϊ2NA
D. Ҷ���屾��������
���𰸡�D
��������
��Ӧ4Fe3++2H2O![]() 4Fe2++4H++O2���У�FeԪ�ػ��ϼ���+3�۽��͵�+2�ۣ�����ԭ��Fe3+Ϊ��������OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���������H2OΪ��ԭ����Ҷ����Ϊ�������Դ˽��
4Fe2++4H++O2���У�FeԪ�ػ��ϼ���+3�۽��͵�+2�ۣ�����ԭ��Fe3+Ϊ��������OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���������H2OΪ��ԭ����Ҷ����Ϊ�������Դ˽��
A���ɷ�Ӧ4Fe3++2H2O![]() 4Fe2++4H++O2����֪ˮ�ڹⷴӦ��������͵��ӹ���˫�����ã���A��ȷ��
4Fe2++4H++O2����֪ˮ�ڹⷴӦ��������͵��ӹ���˫�����ã���A��ȷ��
B����Ӧ����H+����ҺpH��С����B��ȷ��
C��OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���ÿ���ɱ�״����11.2 L ��![]() =0.5molO2ת��0.5mol��4=2mol���ӣ���Fe3+�õ�����Ϊ2NA����C��ȷ��
=0.5molO2ת��0.5mol��4=2mol���ӣ���Fe3+�õ�����Ϊ2NA����C��ȷ��
D���ɷ���ʽ��֪Ҷ����Ϊ��������D����
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������̬������Ϊ����ѧ��Ӧ������ͨ������ײ������ɵģ����Ǵӷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��1molNO2��1mol COǡ�÷�Ӧ����CO2��NO�����е������仯ʾ��ͼ��
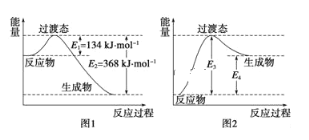
��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��____���÷�Ӧ�Ļ����____kJmol��1��
��ͼ��ijѧ��ģ����ͼ������NO��g��+CO2��g���TNO2��g��+CO��g���������仯ʾ��ͼ����ͼ��E3=__kJmol��1��E4=__kJmol��1��
��2�����ܱ������г���1mol H2��1mol I2��ѹǿΪp(Pa)������һ���¶���ʹ�䷢����Ӧ��H2(g)��I2(g) ![]() 2HI(g) ��H<0����������������ѹǿ���䣬�����м���1molN2����Ӧ����____����������С�����䡱����ƽ��____�ƶ����������Ӧ���������淴Ӧ����������
2HI(g) ��H<0����������������ѹǿ���䣬�����м���1molN2����Ӧ����____����������С�����䡱����ƽ��____�ƶ����������Ӧ���������淴Ӧ����������
��3��T�棬��1 L�ܱ������м���1 mol HI(g)��������Ӧ2HI![]() H2��I2��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
H2��I2��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
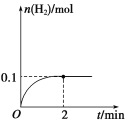
�ٸ��¶��£�2HI(g) ![]() H2(g)��I2(g)��ƽ�ⳣ��K��____��
H2(g)��I2(g)��ƽ�ⳣ��K��____��
����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ�� c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(��)+3B(��)![]() 2C(��)���ﵽƽ��ı�־��
2C(��)���ﵽƽ��ı�־��
A. C������������B�������������
B. A��B��C��Ũ�Ȳ��ٷ����仯
C. ��λʱ��������nmolA��ͬʱ����3nmolB
D. A��B��C�ķ�����֮��Ϊ1��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)=NH4HSO3(aq) ��H1=akJ/mo1��
��NH3��H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2=b kJ/mo1��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3=c kJ/mo1��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O ��H
(1)��H =______kJ/mo1 (�ú�a��b��c�Ĵ���ʽ��ʾ)��
(2)���ڷ�Ӧ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0~10min�ڣ�CO2��ƽ����Ӧ�ٶ�v(CO2)=________��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������_______(����ĸ)��
a.����һ�����Ļ���̿ b.ͨ��һ������NO
c.�ʵ���С��������� d.������ʵĴ���
(3)�û���̿��ԭ������NO���йط�ӦΪ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��
N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��

����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�������ԭ��Ϊ________��
����1100Kʱ��CO2���������Ϊ________��
(4)Ϊ��������β���е��к�����Դ�������Ⱦ�����������װβ������װ�á��ھ���װ����CO��NO������Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
�ٴﵽƽ��������¶ȣ�k������ı���____(����>����<������=��) k������ı�����
������2L���ܱ������г���2molCO��2molNO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ50%����![]() _______��
_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������ѧ���Ѿ����Ƴ���������IJ��ϡ���̼ĤƬ������ֻ��һ��ͷ���Ķ�ʮ���֮һ����ͼ��ʾ������̼ĤƬ��״��䳲������̼ԭ�ӹ��ɵ������ε�Ԫ������չ���ɣ������й�̼ĤƬ��˵���У���ȷ���ǣ� ��
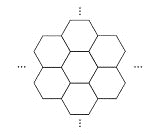
A. ̼ĤƬ����һ�����͵Ļ�����
B. ̼ĤƬ��ʯī�Ľṹ��ͬ
C. ̼ĤƬ��C60��Ϊͬ��������
D. ̼ĤƬ����������ȫȼ�յIJ����̼����������ȫȼ�յIJ��ﲻͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����ͼ���������б�Ҫ�����Ӳ���գ�
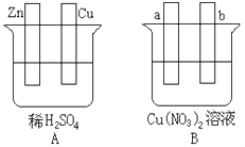
��1����Aͼ�У�ʹͭƬ��ð���ݡ�����Ա�Ҫ���ӣ������Ӻ��װ�ý�__���缫��Ӧʽ��п�缫��___��ͭ�缫��__��
��2����Bͼ�У�a��b��Ϊ���Ե缫����ʹa������ͭ����b������___�����Ա�Ҫ�����Ӻ�װ�ý�___���缫��Ӧʽ:b����___������һ��ʱ���ֹͣ��Ӧ��������Һ����Һ��pHֵ__�����ߡ����͡����䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ�ӹ��������з���X�����ַ���������ݷ���1�ͷ���2ָ������˵���к�������(����)

A. ����ѡ�÷���1����̼�������к��е��Ȼ��
B. ����1�еIJ�����Ӧ�þ��е������������ӷ�
C. ����2�м�����Լ�һ���ܹ����X������ʷ�����ѧ��Ӧ
D. ����2�м���NaOH��Һ���Է����SiO2��Fe2O3������е�Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��صķ����ǻ�ѧ�������һ���ش��ס�
I����ͼ��ʾ���ձ��ж�ʢ��ϡ���ᡣ
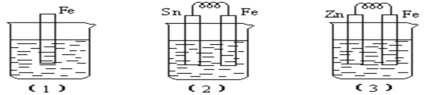
(1)�з�Ӧ�����ӷ���ʽΪ______________��
(2)�еĵ缫��Ӧ��Fe��______________��Sn��______________Sn��������Һ��pH______________��������С�䣩��
(3)�б���ʴ�Ľ�����______________���Ƚ�(1)��(2)��(3)�д�������ʴ�������ɿ쵽����˳����______________
II������������ԭ��Ӧ��Cu��2Fe3��=2Fe2����Cu2�� ��Ƶ�ԭ�����ͼ��ʾ��
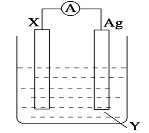
(1)�缫 X �IJ�����_____���������Һ Y ��_____��
(2)Ag �缫�Ϸ����ķ�ӦΪ��_________��
(3)�������ԭ���װ�ã�����˵���в���ȷ����_____����˫ѡ��
A��ԭ��ع���ʱ���ܷ�Ӧ��Cu��2Fe3��=2Fe2����Cu2��
B��ԭ��ع���ʱ��X �缫�������ӣ�����������Ӧ
C��ԭ��ع���ʱ�����缫�Ϸ���������Ӧ
D��ԭ��ع���ʱ���������� Ag ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�����׳ƹ���˫��ˮ��������Ӧ����ϴ�ӡ�ӡȾ����֯����ֽ��ҽҩ�����������У������Ʊ�ԭ����·�����£�
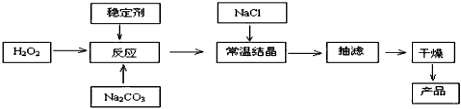
��֪��2Na2CO3 + 3H2O2 =2Na2CO3��3H2O2 ��H<0
��ش��������⣺
��1���������ʿ�ʹ��̼���ƽϿ�ʧЧ����_________________��
a��MnO2 b��H2S c��ϡ���� d��NaHCO3
��2������NaCl��������_________________��
��3����ҵ�����к���Fe3+�����ʣ������ȶ�������������Fe3+�����ȶ�������Fe3+�Է�Ӧ�IJ���Ӱ����_________________��
��4����Ӧ������¶ȿ�����15�桫20�棬�¶�ƫ��ʱ��ɲ��ʵͿ�����_________________��
��5��������������©��һ����������ò�Ʒ����ƫ�ͣ��ò�������������_________________�����иò����ķ����ǣ�_________________��
��6��Ϊ�ⶨ��Ʒ�Ĵ��ȡ�
ȷ��ȡag��Ʒ���250mL��Һ����ȡ25.00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͳ�100mL���������������ø�����ر���Һ�ζ�����������MnO4-�Ļ�ԭ������Mn2+����cmol/L KMnO4����ҺVmL�ζ�����Һ���ζ������յ��������________________��
�ظ��ζ����Σ�ƽ������cmol/L KMnO4����ҺVmL�����Ʒ�й�̼���Ƶ���������Ϊ______________������cmol/L KMnO4����Һʱ����Һʱ������Һ�彦�������Ʒ�Ĵ��Ƚ�_________�����С�䣩��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com