
【题目】室温下向10ml 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
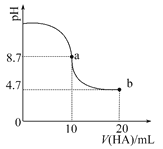
A. a点所示溶液中c(A-)+c(HA)=0.1mol·L-1
B. b点所示溶液中c(HA)>c(A-)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度a>b
科目:高中化学 来源: 题型:
【题目】
有机物A~K有如下转化关系,E、H能与FeCl3溶液发生显色反应,I转化的产K只有一种结构,且K能使溴的CCl4溶液褪色。

已知:① D的质谱与核磁共振氢谱图如下:
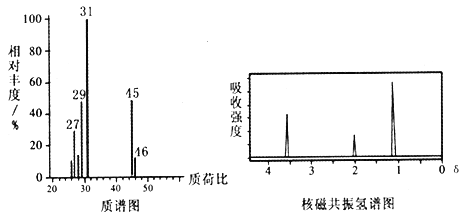
② 两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:CH3CH(OH)2→CH3CHO + H2O。
请回答下列问题:
(1)C中官能团的名称是_______;H→I的反应类型是__________。
(2)K的结构简式为________;条件a为______。
(3)写出下列反应的化学方程式:
①F→G_________。
②A→B + E__________________。
(4)L是相对分子质量比H大14的同系物,同时符合下列条件L 的同分异构体有____种。
a.与FeCl3溶液有显色反应 b.能与NaHCO3溶液发生反应
其中苯环上的一溴代物只有两种的L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X 的路线如下:
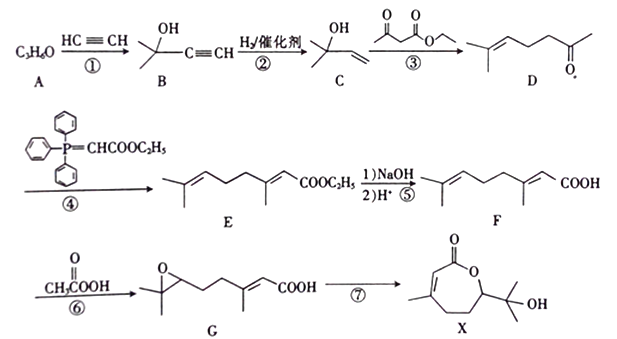
(1)X中含氧官能团的名称为________;A的核磁共振氢谱只有一组吸收峰,A的结构简式为____________。
(2)反应①的反应类型为_________。反应①还会得到另一产物H,其分子式为C8H14O2,写出H的结构简式:______________。
(3)反应⑥的产物为G和_________(填结构简式)。
(4)X分子消去一分子水可得物质J,同时满足下列条件的J的同分异构体共有_____种。其中核磁共振氢谱只有六组吸收峰的同分异构体与足量浓溴水反应的化学方程式为__________。
a.能与FeCl3溶液发生显色反应
b.能发生消去反应
c.苯环上只有2个取代基,且分子中只有2个甲基
(5)参照上述合成路线,设计一条以CH3OH、CH≡CH为原料制备聚丙烯醇 的合成路线图(无机试剂任用)。合成路线示例如下:_______________
的合成路线图(无机试剂任用)。合成路线示例如下:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
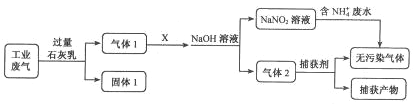
己知:NO+NO2+NaOH=NaNO2+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
请回答下列问题:
(1)固体1中主要含有_________________________ (用化学式表示);
(2)X可以是________(填物质名称),且该物质需要________(填“少量”或“过量”);
(3)捕获剂所捕获的气体主要是________(用化学式表示);
(4)处理含NH4+废水时,发生反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是( )
A.X射线 B.天平 C.质谱 D.核磁共振
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
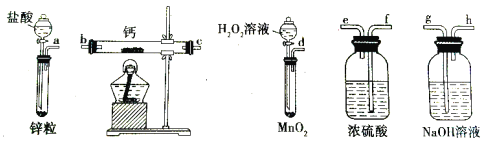
(1)请选择必要的装置,按气流方向连接顺序为____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,________(填操作);④拆除装置,取出产物。
(3)若钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂, 设计实验检验钙的燃烧产物中是否含有过氧化钙________________。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
(4)利用反应Ca2++H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:
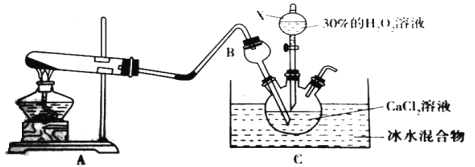
C中沉淀反应时常用冰水浴控制温度在0℃左右,其可能的原因分析:
该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
_______________ ______________。
(5)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入少量2mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3,溶液体积为V mL。
CaO2的质量分数为________(用字母表示)。[已知:I2+2S2O32-=2I-+S4O62-]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com