
【题目】在标准状况下, m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 气体A与气体B的相对分子质量比为m∶n
B. 同质量的气体A与B的分子个数比为n∶m
C. 同温同压下,A气体与B气体的密度比为n∶m
D. 同温同压下,同体积的A气体与B气体的质量比为m∶n
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
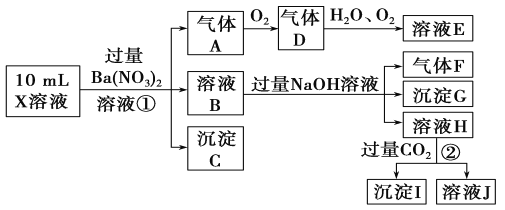
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________________________;可能存在的离子是______________________________;
(2)写出有关离子方程式:步骤①中生成A__________________________;步骤②生成沉淀I___________________________________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量为0.07 mol,能说明该溶液不能确定的阴离子存在的理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y.X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2 , 其水溶液呈弱酸性.完成下列填空
(1)A元素的不同原子有;B原子的核外电子占据了个轨道
(2)C原子核外最外层的电子排布式 , C2和过量X反应的化学方程式 , 每生成1mol单质,转移的电子物质的量为mol
(3)D2的化学性质稳定,原因是
(4)组成为的物质B4A3D2中所含的化学键有 , 其水溶液中各离子浓度大小顺序为
(5)液态X能自身电离,其阴离子电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应(假设空气中的N2和O2体积比为4:1)①3FeS2+8O2→Fe3O4+6SO2 ②4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 .
(2)某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%.每天能生产98%的硫酸吨
(3)硫铁矿煅烧过程中空气用量不同时,发生反应和生成炉气中SO2含量也不同,含FeS2 72%的硫铁矿在空气中煅烧并按反应①完全反应,列式计算炉气中的SO2的体积分数最大为多少?
(4)为确保SO2转化为SO3的转化率,某硫酸厂使用富氧空气(空气中加纯氧)煅烧硫铁矿,炉气中SO2和O2的体积分数分别达到11%和9%,FeS2完全转化为Fe2O3 , 列式计算富氧空气中的氧气体积分数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( ) 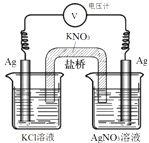
A.该装置工作时化学能转化为电能
B.左池中的银电极作正极
C.总反应为Ag+(aq)+Cl﹣(aq)AgCl(s)
D.盐桥中的K+向右池方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后可生成NA个H2分子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4L N2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种中和胃酸的药物主要成分的化学式Al2Mg6(OH)16CO3·4H2O,1mol
Al2Mg6(OH)16CO3·4H2O中,氧原子的物质的量为( )
A. 16mo1B. 19molC. 20molD. 23mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4 , 过滤;
Ⅱ.向滤液中加入过量MnO2 , 过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是
(2)将MnO2氧化Fe2+的离子方程式补充完整: MnO2+ Fe 2++ ═ Mn 2++ Fe 3++
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 .
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 .
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4﹣与Mn2+反应生成MnO2 . 取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com