
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
(1)写出基态Cu+的核外电子排布式:______;C、N、O三种元素的第一电离能由大到小的顺序是______
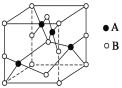
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为__________。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过___键与中心离子Cu2+结合;NH3分子中N原子的杂化方式是____与NH3分子互为等电子体的一种微粒是________(任写一种)。
(4)CuO的熔点比CuCl的熔点________(填“高”或“低”)。
(5)CuO在高温下易转化为Cu2O,其原因是______________。
【答案】1s22s22p63s23p63d10 N、O、C CuO 配位 sp3 H3O+ 高 Cu2O中Cu的d轨道为全充满状态,较稳定
【解析】
(1)Cu原子核外电子数为29,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,则基态Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;
(2)由晶胞示意图可知,1个晶胞中有4个铜,氧为8×![]() +6×
+6×![]() =4个,原子个数之比为1:1,该氧化物的化学式为CuO;
=4个,原子个数之比为1:1,该氧化物的化学式为CuO;
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,NH3分子中N原子的价电子对数 n=![]() ,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;
,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;
(4)离子化合物中,离子半径越小,晶格能越高,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高;
(5)CuO在高温下易转化为Cu2O,其原因是Cu2O中Cu的d轨道为全充满状态,较稳定。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:___(填具体元素符号或化学式,下同)。⑥元素的原子结构示意图是___。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是__,碱性最强的化合物的化学式是___。
(3)最高价氧化物是两性氧化物的元素是_;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式__。
(4)元素③与④形成淡黄色化合物的电子式:___,该化合物属于___(填“共价”或“离子”)化合物。
(5)用电子式表示③与①最高价态形成的化合物的形成过程___,将标准状况下4.48L该化合物通入足量的③和④形成的淡黄色固体化合物中,充分反应后,固体的质量增加___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2和O2于密闭容器中发生如下反应:N2(g)+O2(g)2NO(g)(正反应是放热反应)下列说法正确的是( )
A. 在上述条件下,![]() 能完全转化为NO
能完全转化为NO
B. 升高温度可以提高这个反应的化学反应速率
C. 达到平衡时![]()
D. 加大压强可以加快这个反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H= ______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL-1.则A的平均反应速率v(A)= ______ .该反应达到平衡时A的转化率为 ______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ______ (填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为 ______ (填字母代号).
a 压强不随时间改变 b 气体的密度不随时间改变
c c(A)不随时问改变 d 单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正 ______ v逆(填”大于“、”小于“或”等于“).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子![]() 与线型分子
与线型分子![]() 反应,生成四面体形分子
反应,生成四面体形分子![]() 和直线型分子
和直线型分子![]() 。组成
。组成![]() 分子中的元素的原子序数都小于10,组成
分子中的元素的原子序数都小于10,组成![]() 分子的元素为第三周期的元素。如下图,则下列判断中正确的是( )
分子的元素为第三周期的元素。如下图,则下列判断中正确的是( )

A. 常温常压下, ![]() 是一种液态有机物 B.
是一种液态有机物 B. ![]() 是一种含有非极性键的分子
是一种含有非极性键的分子
C. 干燥的![]() 能漂白有色物质 D. 上述反应的类型是取代反应
能漂白有色物质 D. 上述反应的类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
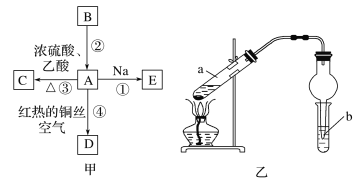
(1)写出B的结构简式__;A中官能团的名称为__。
(2)验证有机物乙酸中含有—COOH最简单的试剂是__,实验现象是__。
(3)实验室利用反应③制取C,常用图乙装置:
①a试管中主要反应的化学方程式为___。反应类型是___。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__。
③试管b中观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写不正确的是( )
A. 乙烯使溴的四氯化碳溶液褪色:Br2+CH2=CH2→CH2BrCH2Br
B. 用惰性电极电解硝酸锌溶液:2Zn2++2H2O![]() 2Zn+O2↑+4H+
2Zn+O2↑+4H+
C. 实验室制乙炔:CaC2+2H2O →C2H2↑+Ca(OH)2
D. 溴乙酸与氢氧化钠溶液共热:BrCH2COOH+OH—![]() BrCH2COO—+H2O
BrCH2COO—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请同学们根据官能团的不同对下列有机物进行分类。
①CH3CH2OH②![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤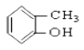 ⑥
⑥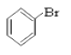 ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]() ⑨
⑨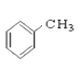 ⑩
⑩ 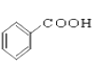
(1)芳香烃:______________;
(2)卤代烃:_______________;
(3)醇:______________;
(4)酚:______________;
(5)醛:______________ ;
(6)酯:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com