
【题目】铝是应用广泛的金属。以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)Al的原子结构示意图为_________;Al与NaOH溶液反应的离子方程式为________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为_______________。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_________,阴极产生的物质A的化学式为____________。
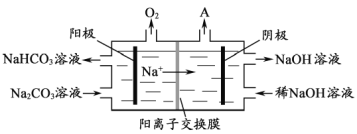
【答案】 2Al+2H2O+2OH-=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O 石墨电极被阳极上产生的氧气氧化 4CO32-+2H2O-4e-=4HCO3-+O2↑ H2
2Al+2H2O+2OH-=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O 石墨电极被阳极上产生的氧气氧化 4CO32-+2H2O-4e-=4HCO3-+O2↑ H2
【解析】
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气;据以上分析解答。
(1)A1原子的核电荷数为13,原子结构示意图为 ;A1与NaOH溶液反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
;A1与NaOH溶液反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)“碱溶”时氧化铝与碱反应生成偏铝酸钠,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(3)“电解Ⅰ”是电解熔融Al2O3得到氧气和铝;电解过程中作阳极的石墨易消耗,是因为阳极生成的氧气与阳极材料碳反应,不断被消耗;
(4)由图可知,阳极区水失去电子生成氧气,剩余的氢离子结合碳酸根生成碳酸氢根,电极方程式为4CO32-+2H2O-4e- ═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,则阴极产生的物质A的化学式为H2。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)
(2)加入试剂b所发生反应的化学方程式为___________________________________。
(3)该方案能不能达到实验目的:_____________,若不能,应如何改进?(若能,此问不用回答)________________________________________。
(4)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有如下可供选择的仪器:
A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.量筒 F.托盘天平。
①用托盘天平称得固体B的质量是_________g。
②配制溶液B时,上述仪器中一定不需要使用的有_____________(填字母),还缺少的仪器有__________________________________(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:

请回答下列问题:
(1) A→B的反应类型是________。
(2) E中含氧官能团的名称为________和________。
(3) C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D。写出C的结构简式:________。
(4) 写出同时满足下列条件的D的一种同分异构体的结构简式:________。(不考虑立体异构)
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5) 写出以甲苯和乙醇为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
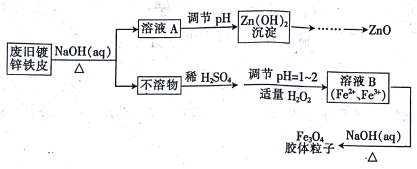
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物的用途广泛,例如:“84”消毒液的有效成分是次氯酸钠,漂白精的有效成分是次氯酸钙,洁厕剂的有效成分是盐酸。已知酸性: H2CO3>HClO>HCO3-。下列有关说法正确的( )
A. “84”消毒液与洁厕剂混合使用,能增强漂白或去污效果
B. 工业上制取漂白粉往往是向澄清石灰水中通入足量氯气
C. 可设计实验装置,用电解饱和食盐水的方法制备次氯酸钠溶液
D. 向“84”消毒液中通入少量CO2,反应的化学方程式为2NaClO+CO2+H2O==Na2CO3+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
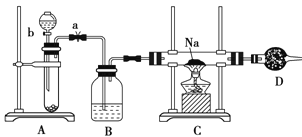
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气”或“无法确定”),判断理由是_________________。
(2)写出A装置中反应的化学方程式并标出电子得失情况:_____________。
(3)B装置中盛放的试剂是__________________,其作用是____________。
(4)C装置中观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
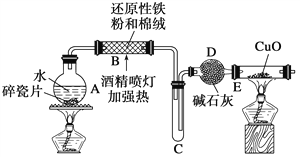
(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
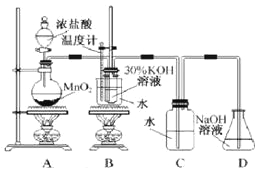
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有__。
(2)若对调B和C装置的位置,__(填“能”或“不能”)提高B中氯酸钾的产率。
实验二:氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
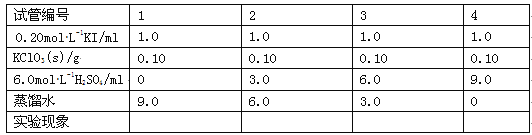
①系列a实验的实验目的是__。
②设计1号试管实验的作用是__。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__。
实验三:测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__。(不考虑实验装置及操作失误导致不可行的原因)
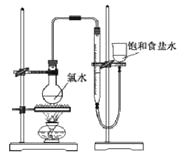
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com