
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )

A.有机物A属于芳香烃
B.1molA和足量的NaOH溶液反应,最多可以消耗4mol NaOH
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A可以和Br2的CCl4溶液发生加成反应
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.lmol·L-1H2A溶液中滴加0.lmol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是( )
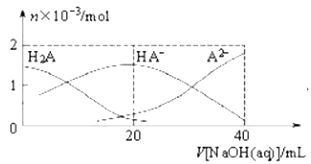
A. H2A在水中的第一步电离的电离方程式为:H2A=HA-+H+
B. c(HA-)/c(H2A)的比值随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol·L-1
D. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法不正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅化学性质稳定,自然界中的硅主要以氧化物及硅酸盐的形式存在
C.![]() 是一种酸性氧化物,能够与强碱反应生成相应的盐
是一种酸性氧化物,能够与强碱反应生成相应的盐
D.除去![]() 中混有的
中混有的![]() 可加入适量的稀盐酸,然后再过滤
可加入适量的稀盐酸,然后再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:
![]()
(1)上述物质中为红棕色气体的是____(填化学式);
(2)NH3溶于水所得溶液呈___(填“酸性”、 “碱性”或“中性” );
(3)配平NO2→HNO3的化学方程式:3NO2 +H2O = ___HNO3 + NO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烃的分子式为C5H12,符合该分子式的同分异构体有3种,其中一卤代物有一种结构,此烃的结构简式为:_________________ .用系统法命名: ________________.
Ⅱ.已知乳酸的结构简式为 ![]() .试回答:
.试回答:
(1)乳酸分子中含有_____________和____________两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式______________________________
(3)乳酸与Na2CO3溶液反应的化学方程式为_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
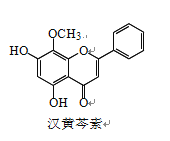
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已渗入我们的“衣、食、住、行、医”中。
(1)衣:区分羊毛线和棉纱线的方法是灼烧,羊毛线燃烧食能闻到__________气味。
(2)食:维生素C能增强人体对疾病的抵抗能力,中学生每天要补充60mg的维C。下列物质富含维生素C的是 ________![]() 填字母
填字母![]() 。
。
A.橙子 ![]() 猪肉
猪肉 ![]() 面粉
面粉
(3)住:下列属于直接利用太阳能辐射能加热物体而获得热能的是 ________![]() 填字母
填字母![]() 。
。
A.石蜡燃烧 ![]() 太阳能热水器
太阳能热水器 ![]() 燃料电池
燃料电池
(4)行:城市交通中大力推广新能源汽车对于改善空气质量的好处是 _______________
A.增加新型污染 ![]() 浪费电能
浪费电能 ![]() 减少空气污染
减少空气污染
(5)医:出现低血糖症状时需要尽快补充葡萄糖,葡萄糖的化学式是________。
(6)淀粉和纤维素是两种重要的多糖,这两种物质________![]() 填“能”或“不能”
填“能”或“不能”![]() 互称为同分异构体,淀粉遇到______显蓝色。
互称为同分异构体,淀粉遇到______显蓝色。
(7)发育出现障碍,患营养缺乏症,这主要是由摄入蛋白质不足引起的,蛋白质在人体内水解的最终产物是________;向蛋白质溶液中加入![]() 溶液会出现白色沉淀,该变化叫作________。
溶液会出现白色沉淀,该变化叫作________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积

(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
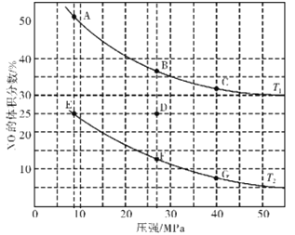
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。

(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com