
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
分析 常温下,VaLpH=2的盐酸与0.2LLpH=12的氨水混合,若所得溶液显酸性,有两种情况:①二者恰好反应生成NH4Cl,NH4Cl水解呈酸性,②盐酸过量;注意一水合氨为弱电解质,氨水浓度大于盐酸浓度.
解答 解:A、两种溶液中c(H+)=c(OH-)=0.01mol/L,一水合氨为弱电解质,故c(NH3•H2O)>c(HCl),若V=0.2,则氨水一定过量较多,溶液呈碱性,故A错误;
B、不可能让V=0.2,故B错误;
C、若盐酸过量很多,则反应后的溶液中c(H+)>c(NH4+),故C错误;
D、若盐酸过量很多,则反应后的溶液中离子浓度可能满足c(Cl-)>c(H+)>c(NH4+)>c(OH-),故D正确.
故选D.
点评 本题考查酸碱混合的定性判断以及离子浓度大小比较问题,题目难度中等,本题注意两点:①混合后溶液呈酸性,②一水合氨为弱电解质.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
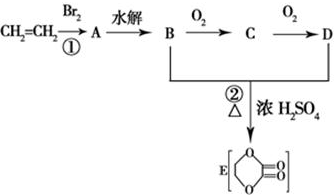
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
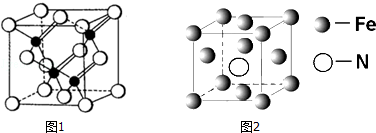
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | NH3、CO2水溶液能够导电,所以NH3、CO2是电解质 | |
| D. | 可用丁达尔效应区别NaCl溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把苯甲酸、甲醇、稀硫酸混合置于有回流设备的装置中,加热,合成苯甲酸甲酯 | |
| B. | 把苯和少量溴水及少量铁屑放在用带导管的瓶塞塞紧瓶口的烧瓶里,反应制取溴苯 | |
| C. | 把醋酸钠晶体(CH3COONa•3H2O)与干燥的碱石灰按一定比例混合后,加热,制取甲烷 | |
| D. | 把浓硝酸、浓硫酸、苯的混合液放在60℃的水浴中反应,制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com