
(14分)某同学欲用右图装置制备乙酸乙酯,其中a试管中是浓硫酸、乙醇、乙酸的混合液, b试管盛饱和Na2CO3溶液。回答下列问题:

(1)指出装置中一个明显的错误
(2)配制浓硫酸、乙醇、乙酸的混合液的正确操作顺序是 。
(3)写出试管a中所发生反应的化学方程式 ,其反应类型为 。
(4)反应结束后振荡b试管的混合液,可观察到b试管中有细小气泡冒出,写出表示该反应的离子方程式 。
(5)从b试管中分离出乙酸乙酯的分离方法是 。
(6)浓硫酸在此反应中的作用是 。
科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高一上学期期末模拟化学试卷(带解析) 题型:实验题
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。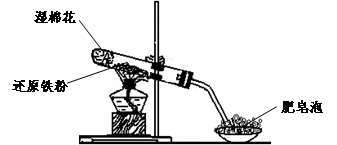
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |


查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高一上学期期末模拟化学试卷(解析版) 题型:实验题
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3 C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:实验题
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2) 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。
查看答案和解析>>
科目:高中化学 来源:2011届山东省济南市高三第二次模拟考试(理综)化学部分 题型:实验题
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: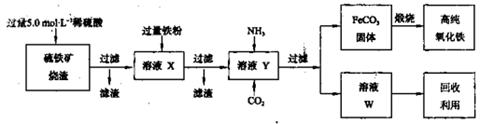
回答下列问题: (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com