
 已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量.
已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| A、若降低温度,可以减慢反应速率 |
| B、催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C、氧气足量时,SO2不能完全转化为SO3 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘与干冰分别受热变为气体 |
| B、硝酸铵与硝酸分别受热变为气体 |
| C、氯化钠与氯化氢分别溶解在水中 |
| D、二氧化硅晶体与冰分别受热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
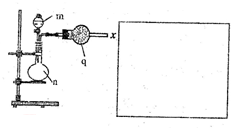 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
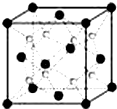 A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com