
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495 kJ·mol-1,其第二电离能增幅较大的原因是___________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,分别是[Cr(NH)3)6]Cl3、___________、[Cr(NH)4Cl2] Cl·2NH3。
(5)NH4N3是在的高能量度材料,其品胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。NH4+的 VSEPR模型名称为___________。
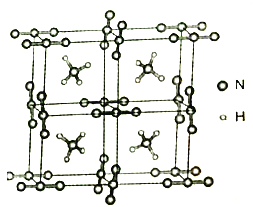
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为___________g·cm-3。
【答案】2s22p3 0.5NA NA N>O>C O原子失去一个电子后,其2p轨道上有3个电子,为半充满状态,较稳定 离子键 [Cr(NH)5Cl] Cl2·NH3 sp 正四面体形 ![]()
【解析】
(1)氮原子序数为7,根据能量最低原则书写;
(2) N2中含有一个![]() 键和两个
键和两个![]() 键,据此计算;
键,据此计算;
(3)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
O原子失去一个电子后,其2p轨道上有3个电子,为半充满状态,较稳定,第二电离能增幅较大;
(4)CrCl3·6NH3中阴阳离子之间为离子键;CrCl3·6NH3有三种异构体,除[Cr(NH)3)6]Cl3和[Cr(NH)4Cl2] Cl·2NH3,还有[Cr(NH)5Cl] Cl2·NH3;
(5) N3-是直线型结构,中心原子价层电子对数为2,则N3-中氮原子的杂化类型是sp;NH4+的价层电子对数为4,没有孤电子对,VSEPR模型名称为正四面体形;
(6)该晶胞中含有4个NH4+和4个N3-,一个晶胞的质量为![]() g,根据
g,根据![]() =
=![]() 计算。
计算。
(1)氮原子序数为7,N原子的核外电子排布式为1s22s22p3,价电子排布式为2s22p3,
因此,本题正确答案是:2s22p3;
(2) 原子轨道以“头碰头”方式形成的共价键为![]() 键,以“肩并肩”方式形成的共价键为
键,以“肩并肩”方式形成的共价键为![]() 键,N2中含有一个
键,N2中含有一个![]() 键和两个
键和两个![]() 键,所以14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为0.5NA,以“肩并肩”方式形成的共价键数目为NA,
键,所以14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为0.5NA,以“肩并肩”方式形成的共价键数目为NA,
因此,本题正确答案是:0.5NA;NA;
(3) C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;
O原子失去一个电子后,其2p轨道上有3个电子,为半充满状态,较稳定,第二电离能较大,
因此,本题正确答案是:N>O>C;O原子失去一个电子后,其2p轨道上有3个电子,为半充满状态,较稳定;
(4)CrCl3·6NH3中Cr3+与NH3之间的化学键为配位键,N-H为极性共价键,阴、阳离子之间为离子键;CrCl3·6NH3有三种异构体,除[Cr(NH)3)6]Cl3和[Cr(NH)4Cl2] Cl·2NH3,还有[Cr(NH)5Cl] Cl2·NH3;
因此,本题正确答案是:离子键;[Cr(NH)5Cl] Cl2·NH3;
(5) N3-是直线型结构,中心原子价层电子对数为2,则N3-中氮原子的杂化类型是sp;NH4+的价层电子对数为4,没有孤电子对,VSEPR模型名称为正四面体形;
因此,本题正确答案是:sp;正四面体形;
(6)该晶胞中含有4个NH4+和4个N3-,一个晶胞的质量为![]() g,一个晶胞的体积为0.5a
g,一个晶胞的体积为0.5a![]() 10-7cm
10-7cm![]() a
a![]() 10-7cm
10-7cm![]() a
a![]() 10-7cm=0.5a3
10-7cm=0.5a3![]() 10-21cm3,则NH4N3的密度为
10-21cm3,则NH4N3的密度为![]() g·cm-3。
g·cm-3。
因此,本题正确答案是:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=![]() B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中探究二氧化氮与过氧化钠的反应。二氧化氮溶于浓硫酸(硫酸沸点为338℃),加热后NO2可逸出。(本题实验装置省略夹持仪器)
(1)制备NO2的装置如图所示:
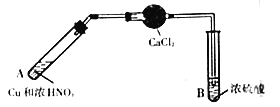
①A中发生反应的化学方程式是___________。
②干燥管内CaCl2的主要作用是吸水,吸水的主要目的是___________。
(2)加热B中吸收液,使NO2逸出,待试管充满红棕色气体后再接入装有足量Na2O2固体的试管,如图:
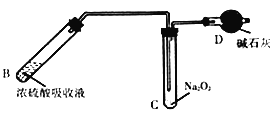
①加热B时,温度不宜过高,原因是___________。
②D中碱石灰的主要作用是___________。
(3)反应后C中固体淡黄色渐渐变白,经分析,反应产物可能有NaNO2、NaNO3,为此,进行如下实验检验:
检验NaNO2:查阅资料可知:NaNO2能使酸性KMnO4溶液褪色。检验过程如下:
取C中固体,加水溶解配制成100mL溶液,加入少量MnO2,振荡静置(记为溶液Q)。取5mL溶液Q,滴加酸性KMnO4溶液,振荡后酸性KMnO4溶液褪色。
①NaNO2使酸性KMnO4,溶液褪色的离子方程式是___________。
②加入少量MnO2的目的是除去剩余Na2O2和水反应产生的H2O2,其化学方程式为______
(4)经检验产物中还含有NaNO3。NO2与Na2O2化合生成NaNO3的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
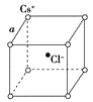
A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验描述、对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq) +3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现 黄色沉淀 | Ksp:AgCl<AgI |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的43倍:________。
(2)烷烃B的碳原子数是5:________。
(3)分子中含有26个电子的烷烃C:________。
(4)室温下相对分子质量最大的气态直链烷烃D:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com