
| A. | 加热TiCl4浓溶液制备TiO2•xH2O2:Ti4++(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4H+ | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量KOH溶液:NH4++OH-═NH3↑+H2O | |
| C. | 钢铁发生吸氧腐蚀时的正极反应:O2+4H++4e-═2H2O | |
| D. | 酸性KI溶液中通入O2:4H++2I-+O2═2H2O+I2 |
分析 A.TiCl4水解TiO2•xH2O,加热可以促进Ti4+的水解;
B.氢氧化钾少量,亚铁离子优先反应;
C.钢铁发生吸氧腐蚀时正极氧气得到电子生成氢氧根离子;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.Ti4+水解生成TiO2•xH2O,则加热TiCl4浓溶液可制备TiO2•xH2O,反应的离子方程式为:Ti4++(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4H+,故A正确;
B.(NH4)2Fe(SO4)2溶液中加入少量KOH溶液,铵根离子不反应,只有亚铁离子反应,正确的离子方程式为:Fe2++2OH-=Fe(OH)2↓,故B错误;
C.钢铁发生吸氧腐蚀时的正极氧气得到电子生成氢氧根离子,正确的电极反应式为:O2+2H2O+4e-═4OH-,故C错误;
D.碘离子在酸性条件下易被氧气氧化成碘单质,正确的离子方程式为:4H++4I-+O2═2H2O+2I2,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 化学变化中,遵循能量守恒,所谓吸热反应可看作把环境中的能量储存到了物质中 | |
| B. | 化学变化中,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化 | |
| C. | 氧化还原反应都是放热反应 | |
| D. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 4:3:18 | C. | 6:2:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭和水反应吸收131.3kJ能量 | |
| B. | 1mol炭和1mol水反应生成CO和H2,并吸收131.3kJ热量 | |
| C. | 固态炭和水蒸气反应生成1mol CO气体和1mol H2气体,并吸热131.3kJ | |
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
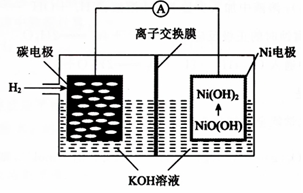
| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “朱”的主要成分是Hg2S | B. | 该反应为置换反应 | ||
| C. | 该反应不符合质量守恒定律 | D. | 该反应Hg作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 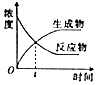 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 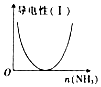 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 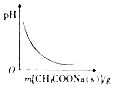 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
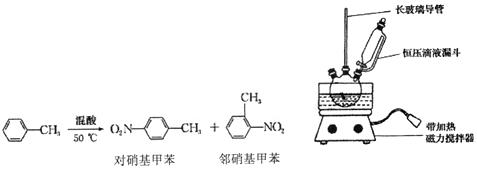
| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com