
分析 (1)从海水中取得淡水的过程谓海水淡化,即利用海水脱盐生产淡水.表面看海水淡化很简单,只要将咸水中的盐与淡水分开即可;
(2)当硬水中钙和镁主要以碳酸氢盐,如Ca(HCO3)2、Mg(HCO3)2形式存在时,称为暂时硬水,当这种硬水加热煮沸时,碳酸氢盐会转化为沉淀除去;如果硬水中钙和镁主要以硫酸盐或氯化物等形式存在,则称为永久硬水,它们不能用煮沸的方法除去;
(3)以硫酸盐或氯化物形式存在时所引起的硬度,则称为永久硬度,加入石灰水只能降低Mg2+所形成的永久硬度,但转变为Ca2+形成的永久硬度,加石灰水发生:Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O,2Ca(OH)2+Mg(HCO3)2=2CaCO3↓+Mg(OH)2↓+2H2O,只能降低暂时硬度,不能降低永久硬度,把部分Mg2+所形成的永久硬度转变为Ca2+形成的永久硬度;
(4)取自江河湖泊中的淡水的处理顺序是:先沉淀、再过滤,最后消毒处理;
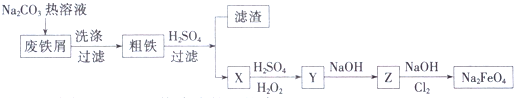
(5)由流程图和实验目的可知,用工业废铁屑(含铜、碳、硅等)制取高铁酸钠,其中X、Y、Z是含铁化合物,碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,滤液为硫酸亚铁,加入硫酸和过氧化氢氧化亚铁离子为铁离子,加入氢氧化钠用生成氢氧化铁沉淀,在氢氧化钠溶液中通入氯气生成高铁酸钠;
①碳酸钠溶液水解显碱性清除废铁屑表面的油污;
②碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅;
③Z为氢氧化铁,在氢氧化钠溶液中氯气氧化氢氧化铁为高铁酸钠,依据原子守恒和氧化还原反应电子守恒配平书写化学方程式;
④高铁酸钠具有强氧化性能杀菌消毒,在反应过程中被还原为铁离子在水溶液中水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用起到净水作用;
⑤电解时阳极发生氧化反应,铁失电子生成高铁酸根离子,由电解质溶液电荷守恒配平写出电极反应方程式.
解答 解:(1)冻结法海水淡化,只有淡水才能结冰,海水的含盐量比较低,冻结后含有盐分的水就排除在外了,把冰取出就是淡水了.
蒸馏法海水淡化,使海水受热汽化,再使蒸汽冷凝,从而得到淡水的方法.
反渗透海水淡化,是在高于溶液渗透压的作用下,依据其他物质不能透过半透膜而将这些物质和水分离开来,
故答案为:冻结法海水淡化、蒸馏法海水淡化、反渗透海水淡化;
(2)当硬水中钙和镁主要以碳酸氢盐,如Ca(HCO3)2、Mg(HCO3)2形式存在时,称为暂时硬水,当这种硬水加热煮沸时,碳酸氢盐会转化为沉淀除去;如果硬水中钙和镁主要以硫酸盐或氯化物等形式存在,则称为永久硬水,它们不能用煮沸的方法除去,但药剂法、离子交换法均可将钙和镁离子浓度减小,降低硬度,
故答案为:bc;
(3)a.以硫酸盐或氯化物形式存在时所引起的硬度,则称为永久硬度,加入石灰水只能降低Mg2+所形成的永久硬度,但转变为Ca2+形成的永久硬度,故a错误;
b.加石灰水发生:Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O,2Ca(OH)2+Mg(HCO3)2=2CaCO3↓+Mg(OH)2↓+2H2O,只能降低暂时硬度,不能降低永久硬度,故b误;
c.加石灰水发生反应:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4; MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,把部分Mg2+所形成的永久硬度转变为Ca2+形成的永久硬度,故c错误;
d.由c分析可知,加石灰水把部分Mg2+所形成的永久硬度转变为Ca2+形成的永久硬度,故d正确;
故答案为:d;
(4)取自江河湖泊中的淡水的处理顺序是:先沉淀、再过滤,最后消毒处理,顺序为②③①,故答案为:②③①;
(5)由流程图和实验目的可知,用工业废铁屑(含铜、碳、硅等)制取高铁酸钠,其中X、Y、Z是含铁化合物,碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,滤液为硫酸亚铁,加入硫酸和过氧化氢氧化亚铁离子为铁离子,加入氢氧化钠用生成氢氧化铁沉淀,在氢氧化钠溶液中通入氯气生成高铁酸钠;
①废铁屑中加入Na2CO3热溶液的目的为清洗废铁屑表面的油污,故答案为:清洗废铁屑表面的油污;
②粗铁加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,故答案为:Cu、Si;
③Z为氢氧化铁,在氢氧化钠溶液中氯气氧化氢氧化铁为高铁酸钠,Cl2将Z氧化为Na2FO4 的化学方程式为10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O,
故答案为:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
④高铁酸钠消毒后的还原产物具有净水作用,其净水原理高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3,具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用为,
故答案为:高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3,具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用;
⑤电解时阳极发生氧化反应,铁失电子生成高铁酸根离子,由电解质溶液配平电荷守恒可知电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O,
故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题考查混合物分离提纯及物质制备实验,为高频考点,把握物质的性质、流程中的反应为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取铝 | |
| C. | 铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物 | |
| D. | Na2O2、NaOH、NH4Cl均为含共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,实验室制取氨气有几种方法,
如图,实验室制取氨气有几种方法,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com