



科目:高中化学 来源: 题型:
| A、达到平衡后,减少A2的量,平衡正向移动 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度平衡正向移动 |
| D、达到平衡后,减小压强平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-) |
| B、c(NH4+)<c(Cl-) |
| C、c(NH4+)=c(Cl-) |
| D、不能确定c(NH4+)与c(Cl-)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
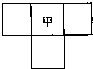 甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.
甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 原子结构或元素性质 |
| X | 最高正价=|最低负价| |
| Y | 原子核及核外各层电子的排布情况如图: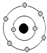 |
| Z | 原子结构示意图: |
| L | 原子半径为同周期主族元素中最大 |
| M | 其原子序数比L大2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HNO3 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2的溶解度最小 |
| B、Ca(OH)2的溶解度最小 |
| C、AgCl的溶解度最小 |
| D、物质Ksp越大溶解度也越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com