
【题目】氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。
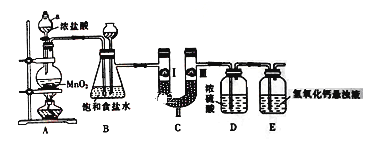
(1) 仪器a的名称为_______________。
(2) 装置B中饱和食盐水的作用是_________________;
(3) 写出A装置中发生反应的化学方程式______________________
(4) 装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入__________(填字母)。
选项 | a | b | c |
I | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5) 装置E中氢氧化钙悬浊液的作用是___________________,同时该装置工业上可用来制取漂白粉,请写出相应反应的化学方程式:___________________。
【答案】分液漏斗 除去HCl MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O c 吸收尾气 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
MnCl2+Cl2↑+2H2O c 吸收尾气 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
【解析】
(1)由仪器a的结构分析解答;
(2)制备的氯气中含有HCl,结合氯气和氯化氢的性质分析饱和食盐水的作用;
(3)依据实验室制取氯气的试剂和反应产物书写化学方程式;
(4)通过Ⅰ、Ⅲ的有色布条对比验证,Ⅱ处为干燥剂,只能为固体干燥剂且不能与氯气反应,D中浓硫酸防止E中水蒸气进入C中;
(5)氯气有毒,氢氧化钙溶液吸收氯气,防止污染环境。
(1)由仪器a的结构可知,a为分液漏斗,故答案为:分液漏斗;
(2)盐酸易挥发,制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl气体,故答案为:除去Cl2中的HCl气体;
(3)制备氯气选用的药品为固体二氧化锰和浓盐酸,加热时反应的化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)通过Ⅰ、Ⅲ的有色布条对比验证,Ⅱ处为干燥剂,只能为固体干燥剂且不能与氯气反应,D中浓硫酸防止E中水蒸气进入C中,装置C中Ⅰ、Ⅱ、Ⅲ处依次放入湿润的有色布条、氯化钙、干燥的有色布条,故选c;
(5)氯气有毒,装置E中氢氧化钙可以吸收多余的Cl2,防止污染空气,反应化学方程式为:2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O,故答案为:吸收多余的Cl2,防止污染空气;2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)
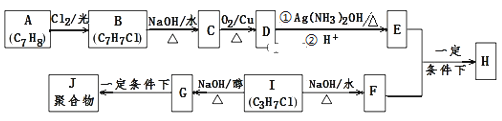
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
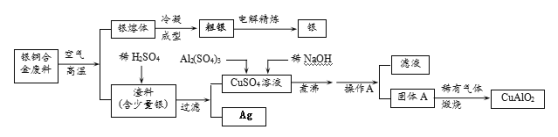
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
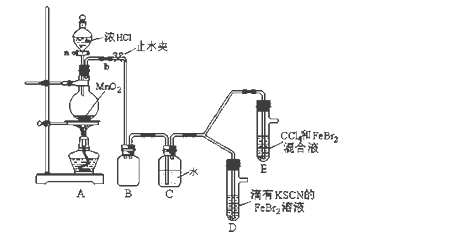
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法会对人体健康造成较大危害的是( )
A. 用小苏打(NaHCO3)焙制糕点
B. 用大量SO2漂白馒头
C. 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D. 用消毒液(有效成分NaClO)对医用物品进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(各种转化见图)。下列说法正确的是
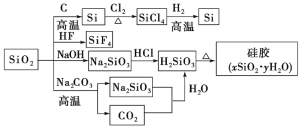
A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. SiO2和Si都是光导纤维材料
C. 硅胶吸水后可重复再生
D. 图中所示转化反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有两种活性反应中间体离子,它们的离子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
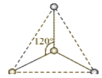 ___________;
___________;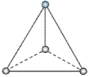 ______________。
______________。
(2)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
(3)写出SO3的常见的等电子体的化学式:一价阴离子____________ (写出一种,下同),二价阴离子____________,它们的中心原子采用的杂化方式都是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
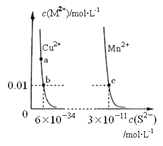
A. a点对应的Ksp大于b点对应的Ksp
B. 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C. 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10﹣23:1
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com