
| A. | KOH | B. | NH3 | C. | H2O | D. | CaCl2 |
科目:高中化学 来源: 题型:解答题
 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
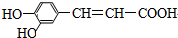
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
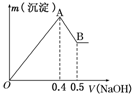 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
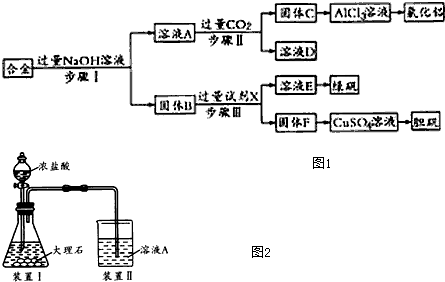
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 滴入溴水后,反应生成产物的结构简式为
滴入溴水后,反应生成产物的结构简式为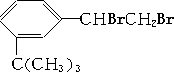 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com