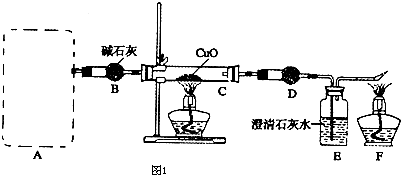
某研究性学习小组探究碳化铝的性质:发现碳化铝与水在常温下剧烈反应,生成大量气体和白色沉淀,该沉淀既能溶于盐酸也能溶于NaOH溶液,该小组同学为了探究气体产物的组成,设计出如图1所示实验:
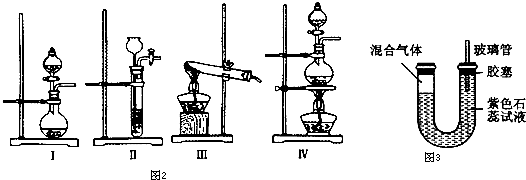
(1)利用碳化铝制取气体,图2装置中适合作为气体发生装置的是
.
(2)正确选择发生装置后,连接装置进行实验.一段时间后,硬质玻璃管C中黑色粉末变成红色,干燥管D中白色粉末变成蓝色,装置E中澄清石灰水变浑浊,尾气燃烧产生蓝色火焰.
①干燥管D中的试剂可能是
,其作用是
.
②根据实验现象,某同学得出下列推论,其中正确的是
.
a.气体与氧化铜在一定条件下反应,氧化产物只有二氧化碳
b.气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳
c.气体与氧化铜在一定条件下反应,产物一定有水、二氧化碳和一氧化碳
d.气体具有还原性,氧化产物可能有多种
(3)实验完毕后,要先后熄灭C和F处的酒精灯,应后熄灭的是
处酒精灯,理由是
.
(4)若最后在F处点燃气体与在A处产生的气体相同,实验前系统内的空气已排尽,实验验结束后,C装置减轻12.8g,D装置增重7.2g,E装置增重8.8g(假定D、E吸收气体是完全的),则A、C处发生反应的方程式分别为
、
.
(5)如图3所示,U型透明玻璃管的左端封闭有A处产生气体和氯气的混合气,将该装置放在日光灯下.一段时间后(不考虑水与氯气的反应),下列关于U型管中可能出现的现象的叙述中正确的是
a.U型管左侧会有油状液滴出现
b.溶液很快变成蓝色
c.气柱缩小,右端液柱下降
d.气柱膨胀,右端玻璃管中液体溢出.





 同步练习强化拓展系列答案
同步练习强化拓展系列答案 用如图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是( )
用如图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是( ) 根据物质结构与性质的关系,请回答下列问题:
根据物质结构与性质的关系,请回答下列问题: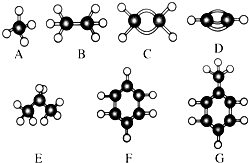 A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是: 杯芳烃因其分子形状与希腊圣杯相似而得名,又因可以作为酶模拟物发挥出离子载体、分子识别和包含酶催化活性等特殊功能,而成为人们关注的一个新的研究课题.“对特丁基杯[4]芳烃”的结构如图所示[图中的“+”为(CH3)3C-].试填空:
杯芳烃因其分子形状与希腊圣杯相似而得名,又因可以作为酶模拟物发挥出离子载体、分子识别和包含酶催化活性等特殊功能,而成为人们关注的一个新的研究课题.“对特丁基杯[4]芳烃”的结构如图所示[图中的“+”为(CH3)3C-].试填空: